肿瘤相关巨噬细胞在胆管细胞癌中的作用
韩品盛, 杨 龙, 崔 涛, 张雅敏
1 天津医科大学 临床医学院, 天津 300070;
2 天津市第一中心医院 肝胆外科, 天津 300192;
3 天津药物研究院 释药技术与药代动力学国家重点实验室, 天津 300000;
4 中国医学科学院 药物代谢新技术创新单元, 北京 100730
胆管细胞癌(cholangiocarcinoma,CCA)是一种侵袭性高、预后极差的胆道恶性肿瘤,5年存活率<10%[1],可发生于胆道树的任何分支,按解剖位置可分为肝内胆管细胞癌(intrahepatic cholangiocarcinoma,iCCA)、肝门周围胆管细胞癌(perihilar cholangiocarcinoma,pCCA)或远端胆管细胞癌(distal cholangiocarcinoma,dCCA),其中pCCA和dCCA统称为肝外胆管细胞癌(extrahepatic cholangiocarcinoma,eCCA)。手术切除是所有亚型CCA的首选治疗方案,但其早期诊断困难,周围组织解剖关系复杂,患者往往丧失手术机会。吉西他滨和顺铂联合化疗方案常用于不能手术的CCA患者,然而有报道称其中位总生存期不足1年[2]。因此,对CCA发生发展机制的探索和临床治疗转化具有重要的现实意义。
在肿瘤发生发展过程中,从外周血迁移到肿瘤组织中的巨噬细胞被称为肿瘤相关巨噬细胞(tumor-associated macrophage,TAM) ,在肿瘤的增殖、侵袭、转移、血管生成等方面发挥着重要的作用[3]。TAM一般分为两种,一种是杀伤肿瘤的M1型巨噬细胞(经典活化型巨噬细胞),可以通过细胞表面抗原识别出不同于正常组织的肿瘤细胞,并产生一氧化氮、活性氧簇等肿瘤杀伤因子杀伤肿瘤细胞,另一种是促进肿瘤进展的M2型巨噬细胞(替代活化型巨噬细胞),可以分泌白细胞介素(IL)-10、血管内皮生长因子(VEGF)、基质金属蛋白酶(MMP)等细胞因子,在肿瘤的血管生成及转移中发挥重要作用[4]。M1和M2型巨噬细胞受肿瘤微环境(tumor microenvironment,TME)的影响会不断发生动态转化,这一过程称为“巨噬细胞极化”。研究[5]表明在大多数肿瘤中,TAM的特征与M2型巨噬细胞更为相近。
TAM参与了CCA的免疫逃逸、细胞增殖、血管生成、肿瘤转移、免疫耐药等过程,并且在CCA免疫治疗中具有重要意义。因此,本文对TAM促进CCA进展的机制和靶向TAM的免疫治疗作一综述。
CCA细胞通过分泌细胞因子,包括单核细胞趋化蛋白(monocyte chemotactic protein,MCP)1、集落刺激因子(colony-stimulating factor,CSF)1和VEGF-A[6],将外周血中的单核细胞募集到肿瘤组织中,并诱导TAM向M2型巨噬细胞方向极化,大量的M2型TAM在肿瘤周围聚集,促进肿瘤血管生成和转移。在另一项研究中,Raggi等[7]构建了一种CCA干细胞样微球体模型,该模型通过释放IL-13、IL-34和骨活素等细胞因子,将血液中的单核细胞募集到肿瘤组织,也可以促进其向M2型TAM方向极化。此外,在缺氧环境中的肿瘤细胞通过分泌嗜酸性粒细胞趋化因子和抑瘤素M将TAM募集到肿瘤部位并促使其向M2型TAM极化[8]。
肿瘤相关成纤维细胞(cancer-associated fibroblast,CAF)是TME中的一种重要组成成分,在肿瘤的发生发展中发挥着必不可少的作用,近年来的研究[9]显示,CAF也与肿瘤细胞的免疫逃逸密切相关。CAF通过分泌趋化因子 CXCL12、CSF-1、IL-6和CC类趋化因子配体(C-C motif ligand,CCL)2等细胞因子,促进单核细胞向肿瘤微环境募集并分化为TAM[10],介导肿瘤的免疫逃逸。
综上所述,CCA细胞或TME中的其他细胞可以通过释放细胞因子的方式,将TAM募集到肿瘤组织中,并将其极化为M2型TAM,之后M2型TAM通过多种方式促进胆管癌的进展。
2.1 TAM介导CCA的免疫逃逸 近年来,随着对CCA免疫治疗研究的深入,越来越多的研究表明CCA免疫治疗的临床效果较差,这主要是由于TME中免疫抑制相关细胞的作用,其中M2型TAM对CCA逃避宿主的免疫监视起到了重要作用。M2型TAM分泌大量的精氨酸酶1(Arginase 1,Arg1),Arg1可以耗尽CCA组织中的精氨酸并产生多胺,多胺具有较强的免疫抑制作用,促进CCA的免疫逃逸[11-12]。
此外,TAM分泌的CCL2可以刺激肿瘤浸润淋巴细胞分化为CD4+/CD25+的调节性T淋巴细胞(Treg)[13],Treg通过分泌IL-10和TGFβ,抑制细胞毒性 T 淋巴细胞 (CTL)和自然杀伤细胞的活化,介导肿瘤的免疫逃逸,Treg还可结合IL-2,使其在TME中失活,抑制免疫应答反应[14]。TAM自身还可以吸引免疫抑制细胞(如Treg)进入CCA组织中,抑制机体免疫应答,介导肿瘤的免疫逃逸[15]。
因此,TAM可以通过产生Arg1、CCL2等细胞因子的方式介导CCA的免疫逃逸。
2.2 TAM促进CCA细胞的增殖 Wnt/β-catenin通路是参与肿瘤增殖的重要通路,Wnt激活后与细胞膜上的受体蛋白Frizzled蛋白相结合,引起细胞质中β-catenin蛋白增多,使得细胞质中游离的β-catenin蛋白进入细胞核,调节基因表达,该通路的过度激活可引起CCA的发生[16]。Loilome等[17]使用TAM的条件培养基培养CCA细胞,结果显示β-catenin表达水平升高,证实TAM可以激活了Wnt/β-catenin 通路,进而促进CCA细胞增殖。Boulter等[18]发现Wnt7b和Wnt10a在人CCA组织以及小鼠CCA异种移植模型中高度表达,进一步实验发现TAM高表达Wnt7b, 并激活Wnt/β-catenin 通路,促进CCA细胞增殖。
此外,另有研究[19]发现TAM可以分泌内含环状RNA的外泌体,与CCA细胞内的微小RNA靶点相互作用,促进CCA细胞的增殖和迁移,这也说明TAM分泌的外泌体可能是TAM和CCA细胞之间的信息传递媒介。
总之,TAM细胞通过Wnt/β-catenin通路和分泌外泌体的方式促进CCA细胞的增殖。
2.3 TAM促进CCA的血管生成 肿瘤血管生成在CCA的恶性转化过程中起到了关键作用,新生的血管为CCA组织提供营养,并促进CCA的转移。TAM在肿瘤血管周围部位聚集,TAM的聚集引起血管生成因子相关基因(表皮调节素、VEGFA和CXCL3)的高表达,从而增加CCA新生血管的生成[15,20]。此外,在CCA肿瘤组织中,TAM通过分泌促血管生成因子,如VEGF-A、血管生成素、IL-8和炎症相关细胞因子,如环氧合酶-2和诱导型一氧化氮合酶,来促进肿瘤新生血管的生成,从而加剧CCA的进展[21]。在CCA中,TAM通过上调血管生成因子相关基因和分泌促血管生成因子促进CCA的血管生成。
2.4 TAM促进CCA的转移 上皮-间充质转化 (epithelial-mesenchymal transition, EMT)在恶性肿瘤的转移中起关键作用,可增强肿瘤的侵袭和转移能力。Sun等[22]将iCCA与TAM共培养,发现其上皮标志物N-钙黏蛋白和紧密连接蛋白表达减少,而间充质标志物E-钙黏蛋白、α-平滑肌肌动蛋白和波形蛋白增多,说明TAM可以促进iCCA细胞的EMT,进一步研究发现TAM通过激活AKT3/PRAS40信号通路促进iCCA细胞的EMT,增强iCCA的转移。Techasen等[23]证明TAM通过分泌IL-4、IL-6、IL-10、TNFα和TGFβ1,使上皮标志物E-钙黏蛋白和细胞角蛋白19表达减少,而间充质标志物钙结合蛋白S100A9和MMP9表达增多,从而促进CCA的EMT。因此,TAM通过AKT3/PRAS40信号通路和分泌细胞因子的方式使上皮标志物的表达减少,间充质标志物的表达增多,促进了CCA的EMT。
2.5 TAM促进CCA的免疫耐药 吉西他滨是治疗CCA的关键药物,对于局部晚期或转移性CCA,顺铂加吉西他滨是最有效的化疗方案[2]。在eCCA中,选取26例肿瘤复发患者接受以吉西他滨为基础的化疗,结果证明TAM、TAN和Treg免疫细胞高表达的患者疾病进展率高于TAM、TAN和Treg低表达组 ,说明TAM等免疫细胞的浸润与患者的不良预后以及吉西他滨耐药有关[24]。
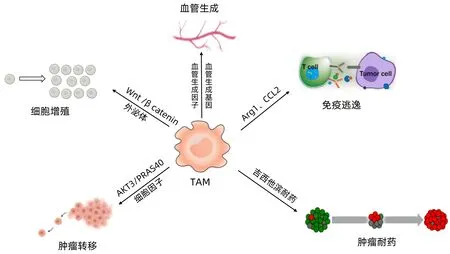
图1 TAM对CCA的作用
有报道[25]称CSF-1的过度表达与肿瘤组织中TAM的募集和极化密切相关。集落刺激因子-1受体(CSF-1R) 是表达于巨噬细胞表面的受体酪氨酸激酶,其配体CSF-1与之结合后可以促进巨噬细胞的增殖、分化和趋化活性增加[26]。在肿瘤的临床前模型中,大量研究[27-28]表明CSF-1R抑制剂可以减少肿瘤组织中TAM的数量,延缓肿瘤进展,延长实验动物生存时间。在小鼠CCA异种移植模型中,CSF-1R抑制剂可以抑制小鼠模型中TAM的募集和极化,使用CSF-1R抑制剂后小鼠移植瘤中CD68+巨噬细胞的数量明显减少,小鼠移植瘤体积和质量也均有减小,说明CCA的CSF-1R靶向治疗效果显著[18]。
MCP-1又被称为CCL2,也是一种很强的TAM趋化激活剂,尽管 MCP-1 的产生曾经被认为是宿主抵御肿瘤的一种表现,但现在认为它可以将TAM募集到肿瘤组织中,从而促进肿瘤的进展[29]。TWAKE与其受体Fn14结合后可激活NF-κB通路分泌MCP-1、IL-6、IL-8、CSF-1和粒细胞-巨噬细胞集落刺激因子,增加TAM在CCA组织中的募集。进一步实验阻断了TWAKE/Fn14通路, MCP-1表达减少,使TAM在CCA组织中的募集减少。此外,向小鼠CCA异种移植模型中多次注射抗MCP-1抗体,小鼠CCA异种移植模型中的移植瘤明显减小且TAM的数量与对照组相比减少了56.5%,说明CCA的MCP-1靶向治疗效果较好[30]。
CD47是一种表达在正常细胞表面的抗吞噬蛋白,属于免疫球蛋白超家族,通过和巨噬细胞表面的信号调节蛋白α(signal regulatory protein α,SIRPα)结合来抑制巨噬细胞的吞噬作用,从而保护正常细胞不被清除。当细胞老化或病变时,细胞表面就会逐渐丧失CD47,以帮助巨噬细胞识别并吞噬这些细胞[31]。有报道称CCA细胞比HCC细胞有着更高的CD47表达,从而通过与巨噬细胞SIRPα结合来“欺骗”巨噬细胞,使巨噬细胞不将其吞噬。抗CD47抗体可以阻断CD47-SIRPA的相互作用导致巨噬细胞吞噬功能增强,从而减轻了小鼠CCA异种移植模型中的肿瘤负荷[32]。
细胞程序性死亡受体(programmed cell death-1,PD-1)和细胞程序性死亡-配体1(programmed cell death ligand 1,PD-L1)的表达是导致肿瘤免疫逃逸的重要机制[33],CCA细胞上的 PD-L1 和T淋巴细胞上的 PD-1 结合后可以抑制CTL的正常免疫活性,减弱机体的免疫应答反应。此外,CCA中的TAM也可以表达PD-L1,介导CCA的免疫逃逸[34]。免疫检查点抑制剂(immune checkpoint blockade,ICB)采用抗原抗体相结合的方式阻断PD-1和 PD-L1的结合,用于CCA的免疫治疗,但由于CCA肿瘤免疫微环境中的免疫抑制细胞TAM和骨髓来源的抑制性细胞抑制了CTL的活性,介导了CAA的免疫逃逸,导致ICB单药治疗效果较差,但Loeuillard等[34]发现将ICB与TAM阻断剂和骨髓来源的抑制性细胞阻断剂联合应用,治疗CCA效果明显提高。
总之,TAM在CCA的免疫逃逸、细胞增殖、血管生成、肿瘤转移、免疫耐药等方面起到重要作用,并作为一种免疫治疗的新型靶点在CCA的临床治疗研究中具有广阔的应用前景,但是TAM靶向治疗的安全性还有待进一步验证。虽然CCA恶性程度高,起病隐匿,但随着近年来研究人员对TME的深入研究,发现了许多例如TAM的特异性靶点,相信随着各种靶向药物的问世,CCA的精准治疗时代即将到来。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:韩品盛负责文献查阅,论文撰写;
杨龙、崔涛负责论文修改,研究指导;
张雅敏负责研究指导,经费支持。
