富血小板纤维蛋白中生长因子含量及释放周期的实验研究
林盘玉 许 放 赵良军
广西医科大学第一附属医院骨科,广西南宁 530021
富血小板纤维蛋白(platelet-rich fibrin,PRF)是第二代血小板浓缩物,含有转化生长因子-β3(transforming growth factor-β3,TGF-β3)、血小板源生长因子-AA(platelet-derived growth factor-AA,PDGF-AA)和胰岛素样生长因子-1(insulin-like growth factor,IGF-1)等多种生长因子,当机体组织出现损伤后,血小板被激活并释放生长因子,在组织创面愈合、血管生成及成软骨分化等过程中发挥重要作用[1]。PRF在凝血酶的作用下形成非溶性纤维蛋白,纤维蛋白进而促进血小板聚集,随着时间的推移,纤维蛋白在一定时期内被逐步降解,血小板分批被激活,能有效提高生长因子释放和利用效率[2]。目前相关研究主要集中于观察富血小板血浆(platelet-rich plasma,PRP)的短期效应,并没有充分观察整个释放时间段和释放趋势[3],有必要深入研究PRP及PRF中生长因子释放量与释放时间的关联性及影响因素,有助于扩大临床应用范围和深度。本研究通过对比PRP与PRF中TGF-β3、PDGF-AA和IGF-1生长因子含量及释放周期,探讨PRF的临床应用优势。
1.1 分组
课题组招募10名健康志愿者,签署试验知情同意书,本研究资料的收集符合医院医学伦理委员会的规定。在双侧肘静脉抽取2管血液,每管各5 ml,按随机数表法将左右两侧2管静脉血分为PRP组和PRF组,在相同条件下制备成PRP和PRF检测样本,备用。
1.2 ELISA法测定PRF中TGF-β3、PDGF-AA和IGF-1浓度
1.2.1 制备培养液 ①从10名健康志愿者双侧肘静脉各获取5 ml血液;
②置入普通离心机内离心,制备PRP和PRF;
③收集EP管内液体并记录样本量,-80℃冰箱留存,标本溶液待测。
1.2.2 测定PRF中TGF-β3、PDGF-AA及IGF-1浓度 ①样品准备:将EP管取出并融化,设置离心参数为2000 r/min,离心20 min,取上清液;
②标准品准备:用1 ml的稀释溶液将标准品稀释到标准浓度,缓慢摇晃10 min,将原液稀释至10 ng/ml,然后在倍数比下稀释成以下浓度:1000、500、250、125、62.5、31.25、15.6 pg/ml,标准品的稀释液作为0 pg/ml;
③按照TGF-β3、PDGF-AA、IGF-1试剂盒(美国Sigma公司,美国,批号:BJ-E687473)进行操作,酶标仪测定OD值,绘制标准品及待测样本OD值浓度曲线。
1.3 PRF显微结构
使用JCM-7000扫描电子显微镜(日本Olympus株式会社,型号:JCM-7000)观察PRF的显微结构。①将离心好的PRF标本置入含有2.5%戊二醛溶液的容器内,固定24 h,依次用PBS缓冲液反复冲洗标本,各3次,每次5 min;
②将标本用25%、50%、75%、90%、100%不同浓度乙醇依次进行脱水,不同梯度每次15 min;
③将标本用20 nm金离子溅射进行包裹镀膜,于金属拖上将标本进行粘连,并做好标记;
④设置15 kV、8000×放大倍数等相关参数,应用扫描电子显微镜进行观察,采集PRF标本上、中、下3段的图像;
⑤对PRF标本图像进行分析,并描述显微结构特点。
1.4 统计学方法
采用SPSS 17.0统计学软件进行数据处理,计量资料用均数±标准差()表示,采用t检验,相关性采用Pearson分析,P< 0.05为差异有统计学意义。
2.1 PRP和PRF中TGF-β3、PDGF-AA和IGF-1的释放总量比较
PRP与PRF中TGF-β3、PDGF-AA、IGF-1的释放总量比较,差异无统计学意义(P> 0.05),见表1。
表1 PRP和PRF中TGF-β3、PDGF-AA和IGF-1的释放总量比较(ng/ml,)
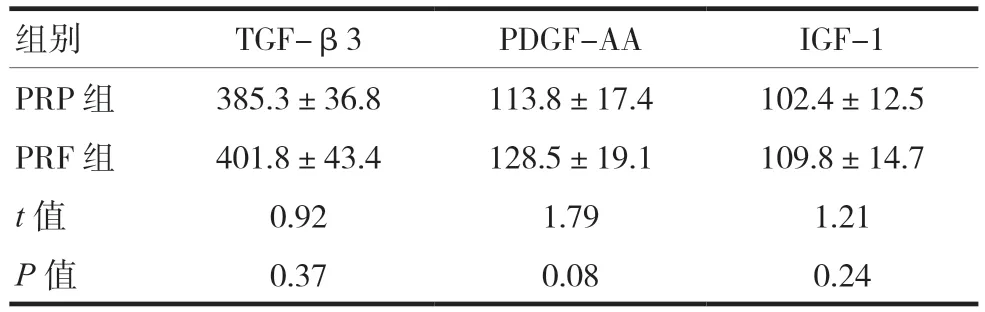
表1 PRP和PRF中TGF-β3、PDGF-AA和IGF-1的释放总量比较(ng/ml,)
注 TGF-β3:转化生长因子-β3;
PDGF-AA:血小板源生长因子-AA;
IGF-1:和胰岛素样生长因子-1;
PRF:富血小板纤维蛋白;
PRP:富血小板血浆
组别 TGF-β3 PDGF-AA IGF-1 PRP 组 385.3±36.8 113.8±17.4 102.4±12.5 PRF 组 401.8±43.4 128.5±19.1 109.8±14.7 t值 0.92 1.79 1.21 P值 0.37 0.08 0.24
2.2 PRP和PRF中生长因子释放周期情况
两组生长因子含量中TGF-β3最高,IGF-1次之,PDGF-AA最少;
PRP中生长因子3 d内达到释放高峰,1周内缓慢释放;
PRF中生长因子在1周内出现释放高峰,3周后释放趋于平稳,不同生长因子的释放高峰出现的时间点不同。
2.3 PRF结构
PRF呈淡黄色胶冻状,质地均匀,富有弹性,去除下层的红细胞碎块,双面加压后PRF呈膜片状物质,质地坚韧,主体部分呈淡黄色,下段少量红色(图1A~B);
电镜扫描结果显示:PRF中胶原纤维束形态规则、结构清晰、表面光滑,纤维束之间相互交联缠绕,呈网状结构,内含血小板、白细胞和红细胞细胞等成分(图1C~D)。
血液主要由红细胞、白细胞、血小板和血浆等多种成分组成,其中红细胞约占44%,白细胞及血小板约占1%,通过设置不同离心参数,可制备出不同状态和结构成分的血小板浓缩物,包括PRP、PRF和生长因子浓缩物(concentrated growth factors,CGF),PRF是第二代血小板浓缩物,通过离心形成非纤溶性纤维蛋白,随着纤维蛋白逐步降解,滞纳于纤维蛋白内的血小板及白细胞逐渐被激活,进而释放生长因子[4-5]。
PRP和PRF中TGF-β3、PDGF-AA和IGF-1的释放曲线相似,释放总量一致,不同生长因子的释放高峰点及持续时间不同。PRF中3种生长因子释放总量对比,TGF-β3最高,IGF-1次之,PDGF-AA最少;
生长因子在1周内出现释放高峰,随后逐渐下降,3周后释放趋于平稳;
He等[6]研究发现PRF在2周内生长因子释放达到高峰,4周后释放趋于平稳,认为生长因子释放曲线具有一定的时间周期性,与本研究结果类似。本实验扫描电镜结果显示胶原纤维束呈网状交叉排列,直径1~2 μm、表面光滑,结构清晰、密度均匀、形态规则,内含大量细胞成分[7]。PRF横截面显示三维网状结构表面胶原纤维束密度及直径更大,中间更为疏松,纤维束间隙更大[8-9],这种特殊构型可能是离心过程中纤维蛋白与离心管壁碰撞引起的,四周致密及中间疏松多孔可以容纳更多的小分子物质,聚集的血小板沿着纤维束之间呈归巢式排列[10-11],血小板与生长因子通过化学键的方式聚集成块,表面致密的胶原纤维可以延缓血小板团块逃逸,随着纤维蛋白逐步降解,血小板被激活,从而延缓生长因子释放,特殊的三维网状构型是其发挥生物学作用的结构基础[12-13]。
PRF生长因子释放量及释放曲线受多种因素影响,生长因子主要来源于纤维蛋白、血小板、白细胞及其他成分,通过降低离心速度和缩短离心时间可以增加生长因子释放量,可能与包含更多未激活的白细胞有关,离心参数改变会引起网状构型变化,从而影响滞纳小分子物质的能力,其次,离心管类型也会影响血小板含量及分布[14];
Kobayashi等[15]发现不同个体间血液成分也存在一定差异性,同样离心条件下PRF生长因子含量也不同,认为生长因子释放量受体内外多种因素影响。
综上所述,PRP和PRF能有效释放生长因子,且释放总量较为一致,但是由于PRF中纤维蛋白逐渐被降解,进而延长了生长因子的释放时间,其释放曲线具有一定的时间周期性。
猜你喜欢高峰总量生长因子“十三五”期间山西省与10省签约粮食总量2230万吨今日农业(2021年3期)2021-12-052020年全国农民工总量比上年减少517万人今日农业(2021年10期)2021-11-27病毒病将迎“小高峰”全方位布控巧应对今日农业(2021年8期)2021-07-28石庆云书香两岸(2020年3期)2020-06-29为何化肥淡储总量再度增加中国化肥信息(2019年1期)2019-01-17雨天早高峰,自在从容时。卫星与网络(2016年12期)2016-02-05鼠神经生长因子对2型糖尿病相关阿尔茨海默病的治疗探索中国医药生物技术(2015年4期)2015-12-26胃癌组织中成纤维细胞生长因子19和成纤维细胞生长因子受体4的表达及临床意义中国现代医学杂志(2015年26期)2015-12-23鼠神经生长因子修复周围神经损伤对断掌再植术的影响西南国防医药(2015年11期)2015-02-28转化生长因子β激活激酶-1在乳腺癌组织中的表达及临床意义疑难病杂志(2014年12期)2014-04-16