地塞米松减轻过敏性哮喘模型小鼠气道炎性反应
刘 芬,胡润芳,茅 松,徐 敏,石文静,陈 凌
上海交通大学附属第六人民医院 儿科,上海 200233
支气管哮喘(bronchial asthma,哮喘)是临床常见的慢性气道炎性疾病,且患病率逐年上升,尽管治疗方案不断更新,但哮喘总体控制水平不容乐观,这与对哮喘气道炎性反应认知不足密切相关。近年,炎性小体与哮喘的研究受到越来越多关注,尤其含NLR家族PYRIN域蛋白3(NLR family,pyrin domain containing protein 3,NLRP3)炎性小体,其参与多种炎性疾病病理过程[1-2]。研究发现,哮喘小鼠肺组织NLRP3表达显著增加,并且高表达NLRP3下游因子IL-1β[3],表明NLRP3/IL-1β信号通路在哮喘气道炎性反应中可能发挥重要作用。吸入性糖皮质激素(inhaled corticosteroids,ICS)是哮喘治疗的主要药物,但其作用机制尚未完全明确。为此本实验旨在研究地塞米松(dexamethasone,DEX)抗炎作用是否与其抑制NLRP3/IL-1β信号通路有关,为哮喘治疗提供新的方向。
1.1 材料
1.1.1 实验动物:6~8周龄SPF级雌性BALB/c小鼠,体质量16~18 g[上海市计划生育科学研究所实验动物经营部,生产许可:SCXK(沪)2018-0006],饲养于单位动物实验中心屏障系统内。
1.1.2 主要试剂:卵清蛋白(ovalbumin,OVA)、氢氧化铝、地塞米松、醋甲胆碱(Sigma-Aldrich公司);
IL-5、IL-6、TNF-α、IL-18和IL-1β ELISA试剂盒(eBioscience公司);
Rat Anti-Mouse NLRP3抗体、Goat Anti-Mouse IL-1β抗体(R&D公司)。
1.2 方法
1.2.1 动物的分组及处理:将小鼠随机分为3组,每组6只动物。哮喘组(OVA组):参考文献[4]建立哮喘模型,实验第0、7、14天皮下注射20 μg OVA、1 mg氢氧化铝混合液致敏,第21、22天以1% OVA混悬液雾化吸入激发20 min;
地塞米松组(DEX组):在OVA组基础上,于每次雾化吸入前3 h腹腔注射地塞米松(2 mg/kg);
对照组(Ctrl组):于相同实验节点给予同等剂量PBS进行皮下注射、腹腔注射或雾化吸入等处理。
1.2.2 小鼠气道高反应性(airway hyperresponsiveness,AHR)的检测:末次雾化结束后,采用小鼠有创肺功能仪测定小鼠气道反应性。小鼠依次进行递增浓度的醋甲胆碱(3.125、6.25、12.5、25、50 mg/mL)雾化吸入,每次3 min,间隔2 min,连续监测并记录。采用生物记录仪检测小鼠气道气流以及气道压力变化,并计算肺通气阻力值。
1.2.3 标本的采集与处理:雾化吸入结束后24 h,腹腔注射3%戊巴比妥过量麻醉后进行标本采集。1)肺泡灌洗液(bronchoalveolar lavage fluid,BALF)收集与处理: 气管插管后以400 μL 0.9%氯化钠溶液进行肺泡灌洗, 回收BALF并离心,上清-80 ℃冻存待测;
重悬细胞沉淀,计数并涂片,Wright-Giemsa染色后进行细胞计数及分类。2)肺组织采集与处理: 肺组织先置于4%多聚甲醛中固定,后用于免疫组织化学及病理学分析。
1.2.4 ELISA测定BALF中IL-5、IL-6、TNF-α、IL-18、IL-1β的浓度:按试剂盒说明书进行操作。
1.2.5 免疫组织化学法检测肺组织NLRP3、IL-1β:常规方法制备肺组织石蜡切片,切片脱蜡、水化,3% H2O2室温封闭10 min,以沸腾的柠檬酸盐缓冲液进行抗原修复,冲洗后加山羊血清封闭,室温孵育10 min,冲洗后加入大鼠抗小鼠 NLRP3抗体、羊抗小鼠IL-1β抗体,4 ℃孵育过夜,37 ℃复温,冲洗后分别加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗,室温孵育1 h,冲洗后加入二氨基联苯胺显色,自来水冲洗终止反应,后苏木精复染,室温孵育后乙醇分化,最后脱水、封片,进行镜检。
1.2.6 肺组织病理分析:取4%多聚甲醛固定的肺组织行HE染色,观察气道炎性细胞浸润情况,并对气道炎性评分[5]:0分指无炎性细胞浸润;
1分指支气管周围偶见炎性细胞;
2分指大部分细支气管周围可见单层炎性细胞浸润;
3分指细支气管周围可见2~4层炎性细胞浸润包绕;
4分指细支气管周围可见4层以上的炎性细胞浸润包绕。每只小鼠随机选取3张切片,每张切片随机选取5个视野进行观察分析。
1.3 统计学分析

2.1 小鼠气道高反应性的测定结果
在高浓度醋甲胆碱溶液(12.5、25、50 mg/mL)激发下,哮喘组小鼠气道阻力明显升高(P<0.01)。与哮喘组小鼠比较,地塞米松组小鼠气道阻力明显降低(P<0.05)(图1)。

*P<0.01,**P<0.001 compared with Ctrl group;
#P<0.05,##P<0.01 compared with asthma group
2.2 BALF中炎性细胞计数及分类
哮喘组小鼠BALF中炎性细胞总数、嗜酸性粒细胞数量、巨噬细胞数量均明显高于对照组(P<0.01);
地塞米松组小鼠BALF中炎性细胞总数、嗜酸性粒细胞数量、巨噬细胞数量则明显低于哮喘组(P<0.05)(图2)。
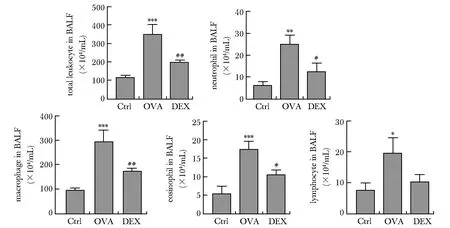
*P<0.05,**P<0.01,***P<0.001 compared with control(Ctrl) group;
#P<0.05,##P<0.01 compared with asthma group
2.3 BALF中IL-5、IL-6、TNF-α、IL-18和IL-1β的浓度测定
与对照组比较,哮喘组小鼠BALF中IL-5、IL-6、TNF-α、IL-18和IL-1β的表达均显著升高(P<0.01);
地塞米松的干预则显著降低哮喘组小鼠BALF中IL-5、IL-6、TNF-α、IL-18和IL-1β的表达(P<0.01)(图3)。
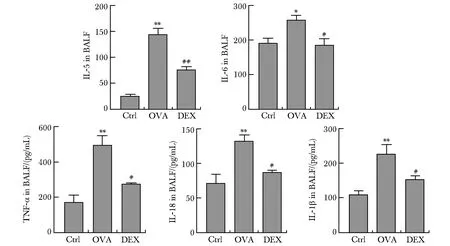
*P<0.01,**P<0.001 compared with control(Ctrl) group;
#P<0.01,##P<0.001 compared with asthma group
2.4 肺组织免疫组织化学检测
哮喘组小鼠肺组织NLRP3、IL-1β表达明显高于对照组,而地塞米松组小鼠肺组织表达则明显降低(图4)。

图4 小鼠肺组织NLRP3、IL-1β的表达
2.5 肺组织病理分析
与对照组比较,哮喘组小鼠支气管及小血管周围炎性细胞浸润明显增多(P<0.001);
而地塞米松干预后的小鼠肺组织内炎性细胞渗出明显减轻(P<0.01)(图5)。

*P<0.001 compared with control(Ctrl) group;
#P<0.01 compared with asthma group
支气管哮喘以气道高反应性、气道炎性细胞浸润及气道重塑为病理特征[6],而哮喘气道炎性过程十分复杂,涉及多种发病机制。地塞米松作为抗炎及免疫抑制剂在医学领域发挥重要作用。目前研究表明,地塞米松可有效减少哮喘小鼠肺组织中嗜酸性粒细胞数量,抑制Th2型细胞因子表达及IgE水平[7]。在本研究中,地塞米松的应用显著抑制了过敏性哮喘小鼠气道高反应性,降低了BALF中嗜酸性粒细胞、中性粒细胞的数量,以及IL-5、IL-6、TNF-α等炎性因子的表达。值得关注的是,地塞米松同时抑制了小鼠肺组织中NLRP3的表达及其下游效应因子IL-18、IL-1β的分泌。
NLRP3炎性小体是一种多蛋白复合物,在内外源性因素刺激下,通过多种方式感知危险信号,并参与过敏原诱发的气道炎性反应[8]。研究指出,NLRP3炎性小体主要表达于气道上皮细胞,而上皮细胞在气道炎性反应中发挥重要的保护作用[9],损伤及病原体侵入则可刺激肺上皮细胞表达活化的NLRP3炎性小体[10-11]。同时,在哮喘患者和动物实验模型中,NLRP3炎性小体的表达均显著增加,而NLRP3炎性小体缺乏则影响Th2细胞的分化过程[12]。同时研究发现,应用抑制剂阻断NLRP3炎性小体的活化可显著减轻哮喘小鼠的气道高反应性及气道炎性反应[13]。进一步研究发现,活化的NLRP3炎性小体通过激活caspase-1,而诱导IL-1β和IL-18的成熟,从而参与调控Th1、Th17等多种免疫细胞的功能[14]。在本研究中,OVA诱导NLRP3炎性小体的活化,促进IL-1β、IL-18等炎性因子的表达,而应用地塞米松则抑制了NLRP3炎性小体的活化过程,并降低其下游主要效应因子的表达,从而有效缓解了过敏性哮喘小鼠的气道炎症。
综上所述,地塞米松降低了过敏性哮喘小鼠气道内IL-6、IL-1β和IL-18等炎性因子的表达水平,减轻了哮喘小鼠的气道高反应性及炎性细胞浸润,这一过程与其抑制NLRP3炎性小体的活化密切相关。本研究丰富了地塞米松治疗哮喘的理论基础,为哮喘的治疗提供新的研究方向,但地塞米松调节NLRP3炎性小体的机制尚未完全明确,仍需进一步深入研究。
猜你喜欢小体性反应雾化肠道菌群失调通过促进炎性反应影响颈动脉粥样硬化的形成天津医科大学学报(2021年3期)2021-07-21慢性咽炎雾化剂含漱治疗慢性咽炎的疗效观察中国医药指南(2017年3期)2017-11-13一种优化小鼠成纤维细胞中自噬小体示踪的方法中国组织化学与细胞化学杂志(2017年1期)2017-06-15哪些情况需要雾化治疗?妈妈宝宝(2017年2期)2017-02-21雾化时需要注意什么?家庭科学·新健康(2016年9期)2016-10-25促酰化蛋白对3T3-L1脂肪细胞炎性反应的影响医学研究杂志(2015年9期)2015-07-01炎症小体与肾脏炎症研究进展西南军医(2015年3期)2015-04-23解读DeVilbiss TTS智能雾化技术汽车维修与保养(2015年6期)2015-04-17NLRP3炎症小体与动脉粥样硬化的研究进展国际心血管病杂志(2015年5期)2015-02-27细胞浆内含有Auer样杆状小体的骨髓瘤1例现代检验医学杂志(2014年6期)2014-03-03