日本沼虾核糖体蛋白S3a基因cDNA的克隆、表达及其在卵巢发育中的功能初探
李屹铮,张帅帅,刘雪巍,张 冉,林鑫辉,张 猛,王 磊,于 淼,乔志刚,江红霞
(河南师范大学水产学院,河南省水产动物养殖工程技术研究中心,水产动物疾病控制河南省工程实验室,河南新乡453007)
日本沼虾(Macrobrachiumnipponense)广泛分布于中国、日本及越南等东南亚国家淡水水域,具有较高的经济价值,是我国重要的淡水养殖甲壳动物。近些年来,由于日本沼虾自然资源锐减,集约化人工养殖被大力发展,然而随着人工养殖规模持续增加,日本沼虾出现了性早熟、个体小、商品率低等种质退化现象,严重制约了日本沼虾养殖业持续健康发展[1]。因此,研究日本沼虾性腺发育规律,对其性腺尤其是卵巢发育进行人工调控,是对其进行人工繁殖和育种,改良其种质的基础。目前,眼柄摘除法是广泛应用的水产甲壳动物卵巢促熟的常规方法[2,3],但是眼柄摘除也会危害甲壳动物生长,缩短其蜕皮周期,增加能量需求,降低卵子质量,并使其死亡率升高[4],因此,寻找新的人工调控甲壳动物卵巢发育的方法势在必行。而从分子水平上寻找甲壳动物卵巢发育相关基因,通过调控这些基因表达来促进或抑制其卵巢发育已成为该研究领域的发展趋势。
核糖体蛋白(ribosomal protein,RP)家族是核糖体的结构蛋白,在生物体蛋白合成中具有极其重要的作用。核糖体蛋白S3a(RPS3a)是真核细胞核糖体蛋白40S小亚基组分,在40S亚基与起始因子和mRNA结合以及80S亚基与延伸因子结合中起重要作用,参与翻译、DNA修复和细胞凋亡[5,6]。此外,RPS3a蛋白被证实还具有调节生物体卵巢发育作用,例如,研究发现当RPS3a基因表达被反义基因抑制时,黑腹果蝇(Drosophilamelanogaster)卵巢发育受到抑制,并导致其产卵失败[7];
RPS3a基因在冈比亚按蚊(Anophelesgambiae)卵巢中高表达,并在其卵子发生过程中表达上调[8];
沉默RPS3a基因表达会阻止非滞育期淡色库蚊(Culexpipiens)的卵巢发育,并使其进入滞育状态[9];
用墨吉对虾(Fenneropenaeusmerguiensis)重组RPS3a蛋白孵育其卵巢外植体会刺激卵巢发育相关基因-虾卵巢围食膜因子(SOP)和翻译控制肿瘤蛋白(TCTP)基因表达[10]:另外,RPS3a也是杂交长白母猪(Susscrofadomestica)卵母细胞发育相关基因,它在其卵母细胞体外成熟过程中表达下调[11]。但迄今为止,对日本沼虾卵巢RPS3a基因的研究尚未见报道。
大量的研究表明,在甲壳动物中,5-羟色胺(5-HT)和多巴胺(DA)可以通过其X-器官窦腺系统神经激素合成和释放来调控它们的卵巢发育[12-14],但关于5-HT和DA对日本沼虾卵巢发育作用的研究迄今为止也未见相关报道。本研究克隆得到了日本沼虾RPS3a基因的cDNA全长序列,命名为MnRPS3a基因,并分析了该基因的序列特征及其在日本沼虾不同组织和不同发育阶段卵巢中的表达模式。为了进一步研究MnRPS3a基因在日本沼虾卵巢发育中的作用,本研究还检测了日本沼虾注射5-HT和DA后其卵巢中MnRPS3a和卵黄蛋白原(Vg)基因的表达变化,最后还进行了MnRPS3a蛋白在日本沼虾不同发育阶段卵巢中的定位分析。本研究旨在为理解甲壳类动物RPS3a基因在其卵巢发育中的作用,从而在分子水平上寻找人工调控甲壳动物卵巢发育的新方法提供理论基础。
1.1 实验材料
1.1.1 日本沼虾不同组织和不同发育阶段卵巢组织的采集
本实验中所用日本沼虾购自新乡市水产品市场,体长为(4.5±0.5) cm,体重为(3.5±1.0) g,暂养于河南师范大学水产养殖基地,养殖水温25~30 ℃,每天早晚各投喂商品饲料1次,1周换水1次。挑选卵巢发育处于Ⅰ期的健康雌虾,冰浴麻醉,采集其不同组织(眼柄、胃、卵巢、肝胰腺、鳃和肌肉)。挑选卵巢发育处于不同发育阶段的健康雌虾,冰浴麻醉,采集其不同发育阶段(Ⅰ-Ⅵ期)的卵巢组织(Ⅰ期:卵原细胞增殖期;
Ⅱ期:卵黄发生前期;
Ⅲ期:初级卵黄发生期;
Ⅳ期:次级卵黄发生期;
Ⅴ期:成熟期;
Ⅵ期:衰退期)样品。每种实验样品均采集5个生物学重复,样品获取后立即放入液氮中保存,以备后续RNA提取。
1.1.2 5-HT和DA刺激实验中日本沼虾卵巢组织的采集
将大小均一、卵巢发育处于Ⅲ期的健康日本沼虾(4.5±0.5 cm,3.5±1.0 g)分为3组,2个实验组和1个对照组。2个实验组分别肌肉注射5-HT(Sigma,美国)和DA(Sigma,美国),注射量为50 μg/g体重,对照组注射相同体积的PBS,分别在注射后的0、12、24、48、72和96 h,每组随机选取5尾虾,取其卵巢组织样品,立即放入液氮中保存,以备后续RNA提取。
1.2 总RNA提取
按照total RNA kit Ⅱ(Omega Bio-Tek,美国)说明,分别提取日本沼虾不同组织、不同发育阶段的卵巢组织、以及注射5-HT和DA后不同时间点的卵巢组织样品总RNA。RNA的完整性用1%的琼脂糖凝胶电泳检测,浓度及纯度用NanoDrop 2000超微分光光度计(Thermo,美国)检测。
1.3 cDNA合成
使用PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit试剂盒(TaKaRa,大连),以日本沼虾卵巢组织总RNA为模板反转录cDNA,-20 ℃保存,以备MnRPS3a核心片段的克隆。另取卵巢总RNA,使用SMARTer RACE 5′/3′Kit(TaKaRa,大连)试剂盒,分别合成5′和3′RACE-ready cDNA,以备MnRPS3a5′和3′两端片段的克隆。遵循Prime Script@RT reagent Kit with gDNA Eraser(TaKaRa,大连)试剂盒的说明对日本沼虾各样品RNA进行反转录,生成的cDNA以备实时荧光定量PCR(qRT-PCR)实验进行。
1.4 MnRPS3a基因cDNA克隆
根据本实验室日本沼虾卵巢转录组测序(NCBI SRA登录号:SRP063589)得到的MnRPS3a基因片段,用Primer 5.0软件设计MnRPS3a中间核心片段引物(表1),通过PCR扩增获得MnRPS3a核心片段,经纯化、克隆后送至生工生物工程(上海)股份有限公司进行测序。根据获得的核心片段序列设计特异性引物(表1)用于5′和3′端扩增。5′和3′端RACE-PCR反应体系和反应程序按SMARTer RACE 5′/3′ Kit(TaKaRa,大连)试剂盒说明设置。扩增产物经过纯化、克隆,送至生工生物工程(上海)股份有限公司进行测序,获得的5′和3′端序列与中间核心片段序列拼接后得到MnRPS3a全长cDNA序列。
1.5 MnRPS3a生物信息学分析
使用NCBI网站(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)确定基因的开放阅读框;
使用在线网站http://www.expasy.org/tools/推测翻译的蛋白质分子式、分子量及等电点,并分析其三级结构;
利用在线网站http://www.dabi.temple.edu/disphos/和http://www.cbs.dtu.dk/services/NetNGlyc/分别预测蛋白磷酸化和糖基化位点;
利用PSORTII(http://psort.nibb.ac.jp/)预测核定位信号;
使用NCBI网站(http://www.ncbi.nlm.nih.gov/BLAST/)分析各物种RPS3a氨基酸序列相似性;
利用Clustal X2进行氨基酸序列多重比对;
利用MEGA 5.0以邻接(NJ)法构建系统进化树。
1.6 基因表达分析
MnRPS3a基因在日本沼虾不同组织和不同发育阶段卵巢组织中的表达,以及注射5-HT和DA后不同时间点卵巢组织中的MnRPS3a和Vg基因表达均利用qRT-PCR法进行。以反转录cDNA为模板,使用LightCycler 96(Roche,瑞士)进行基因qRT-PCR分析,反应体系(10 μL)为:TB Green Premix Ex Taq Ⅱ(TliRNaseH Plus)(2×) 5 μL、正反向引物(10 μmol/L)各0.4 μL、DNA模板1 μL、ddH2O 3.2 μL。qRT-PCR条件为:95 ℃ 30 s;
95 ℃ 5 s、60 ℃ 20 s、40个循环;
95 ℃ 10 s、65 ℃ 60 s、97 ℃ 1 s;
37 ℃ 30 s。以β-actin为内参基因,每个样品设置5个生物学重复和3个技术重复。qRT-PCR过程中所用的各引物序列见表1。基因的相对表达量运用2-△△CT法进行计算,数据以平均值±标准差(Means±SD)表示,使用SPSS 20.0软件和Duncan法进行显著性分析和多重比较分析,P<0.05表示差异显著。

表1 日本沼虾MnRPS3a引物序列Tab.1 Primer sequences of MnRPS3a gene
1.7 MnRPS3a蛋白在日本沼虾卵巢组织中的定位
解剖获取成虾Ⅰ-Ⅴ期卵巢组织,PBS洗涤后,在4%的多聚甲醛中固定24 h,使用梯度酒精脱水和二甲苯逐级透明后用石蜡包埋,制作成4 μm厚的石蜡切片。对一部分切片进行HE染色,用以观察不同时期卵巢的发育阶段。未经HE染色的切片利用免疫荧光(IF)技术进行MnRPS3a蛋白在日本沼虾卵巢组织中的定位分析,将切片常规脱蜡后置于EDTA抗原修复液中,高火加热8 min至沸腾,室温冷却8 min后,中高火再加热8 min,再自然冷却至室温;
滴加山羊血清封闭液(原液用PBS按1∶9稀释),37 ℃孵育30 min。滴加1∶100稀释的兔多克隆抗体一抗(Cat:GTX124922,Proteintech,美国),4 ℃过夜。然后37 ℃复温30 min,PBS洗 5 min×3次;
滴加DyLight 488荧光素标记羊抗兔IgG二抗(Cat:A23220,Abbkine,美国),稀释比例为1∶100,37 ℃ 孵育45 min。PBS洗5 min×3次;
滴加DAPI染色液,室温孵育3 min。PBS清洗,抗荧光淬灭封片剂封片后,用荧光显微镜观察结果并拍照。
2.1 MnRPS3a基因cDNA全长和氨基酸序列分析
MnRPS3a基因cDNA序列(图1)全长902 bp,5′端非编码区53 bp,3′端非编码区48 bp,开放阅读框(ORF区)801 bp,编码266个氨基酸(AA)。MnRPS3a氨基酸序列含有5个磷酸化位点和3个糖基化位点,在其C端有一个核定位信号“KKGLNKAGKKGSKKK”。推测MnRPS3a蛋白分子质量为30.06 kDa,理论等电点为9.78。该基因序列已提交至GenBank,获得序列号为:MK575884。

图1 MnRPS3a基因全长cDNA序列及其所编码的氨基酸(AA)序列Fig.1 cDNA sequence and amino acid sequence of RPS3a gene of M.nipponense下划线指示ORF区的起始密码子(ATG)和终止密码子(TAA),灰色背景部分为poly A加尾信号(AATAAA),黑色三角(▲)指示预测的磷酸化位点,“*”指示预测的糖基化位点,虚线指示核定位信号。
2.2 MnRPS3a氨基酸序列同源性比较及系统进化分析
将MnRPS3a氨基酸序列与其它物种RPS3a氨基酸序列进行相似性分析,结果显示,MnRPS3a与其它比对物种RPS3a序列相似性介于63%~86%之间,并与墨吉对虾RPS3a氨基酸序列相似性最高,达到85.71%。利用Clustal X2软件将MnRPS3a氨基酸序列与其它无脊椎动物RPS3a氨基酸序列进行多重比对,结果(图2)显示,各无脊椎动物RPS3a氨基酸序列的C端均具有一个核定位信号。利用Expasy在线软件预测了MnRPS3a蛋白的三维结构,该蛋白含有34.21% α-螺旋,18.42% β-折叠和47.37%无规则卷曲(图3),比对的其他无脊椎动物同样具有这些α-螺旋和β-折叠结构(图2)。利用MEGA5.0软件构建各物种RPS3a蛋白系统进化树(图4),显示日本沼虾RPS3a与同属于甲壳动物的墨吉对虾RPS3a在进化树中聚为一支,亲缘关系最近。

图2 MnRPS3a与其它无脊椎动物RPS3a氨基酸序列多重比对Fig.2 Multiple comparison of RPS3a amino acid sequences between M.nipponense and other invertebrates使用Clustal X2进行多重序列比对,橙色框内为核定位信号,红色框内为α-螺旋区,蓝色框内为β-折叠区,各无脊椎动物RPS3a NCBI登录号见图4。
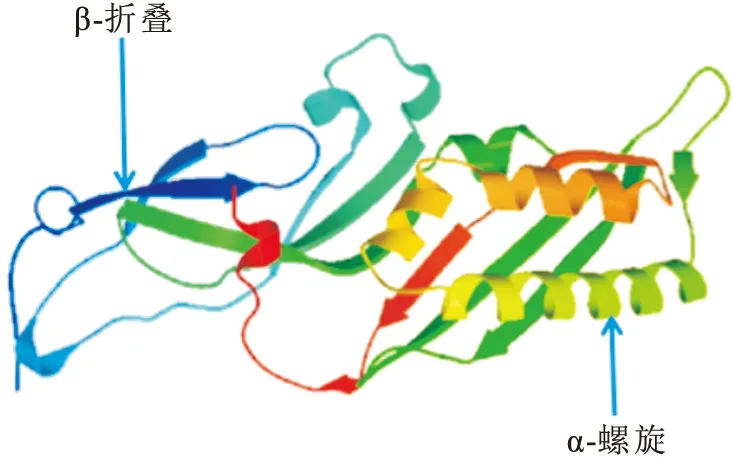
图3 MnRPS3a蛋白三级结构预测Fig.3 Prediction of tertiary structure of MnRPS3a protein
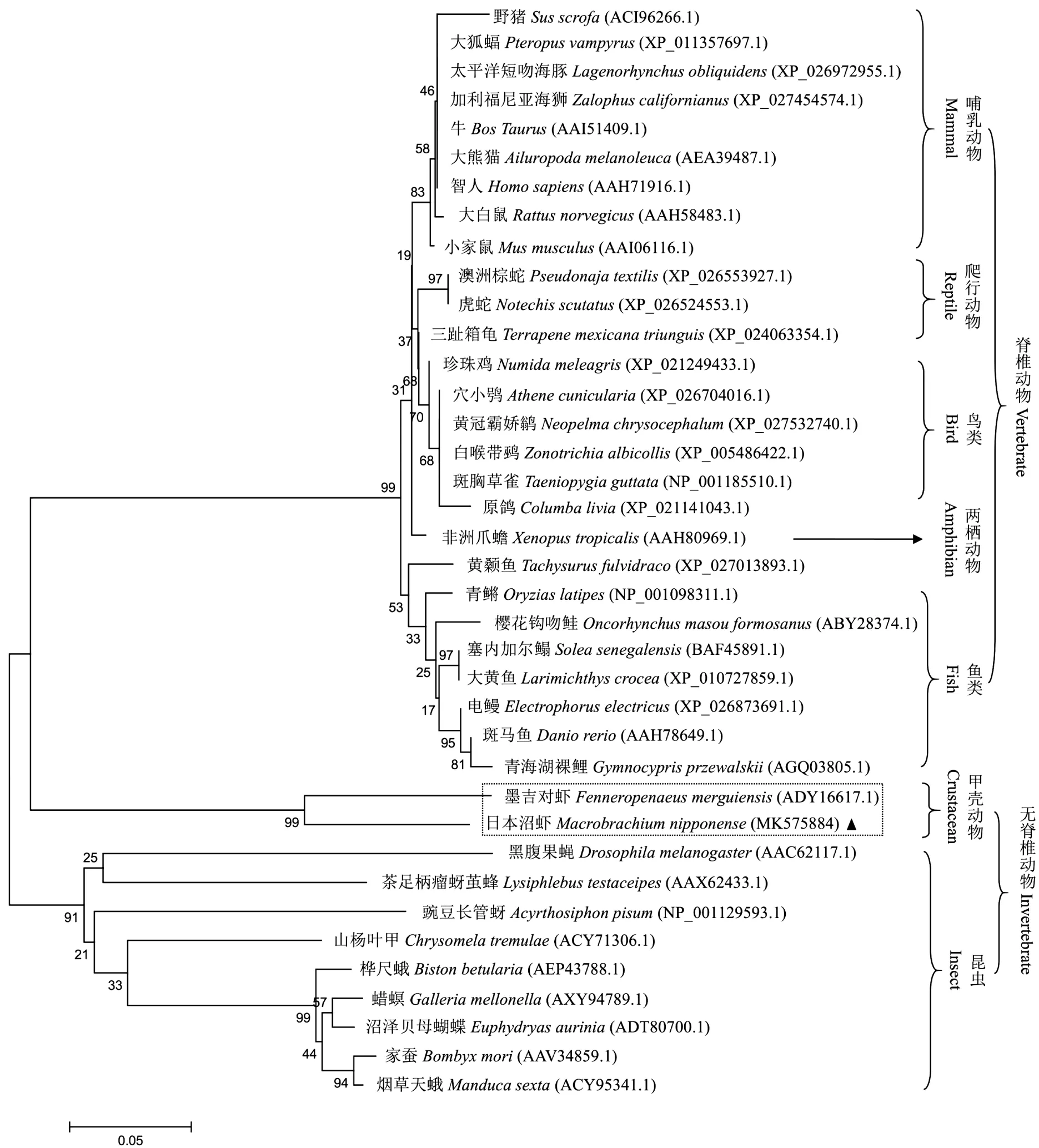
图4 各物种RPS3a系统进化树Fig.4 NJ phylogenetic tree based on RPS3a amino acid sequences of various organisms
2.3 MnRPS3a基因的组织表达
MnRPS3a基因在Ⅰ期卵巢日本沼虾不同组织中的表达水平见图5。结果显示,MnRPS3a基因在所测组织中均有表达,其在肌肉中表达量最高,并且显著高于其它各组织,其在胃中的表达量最低,但其在卵巢组织中的表达量与眼柄、肝胰腺和鳃相比并无显著差异。
2.4 MnRPS3a基因在不同发育阶段卵巢组织中的表达
MnRPS3a基因在日本沼虾不同发育阶段卵巢组织中的表达结果(图6)显示,该基因表达量随着卵巢的发育呈现出逐渐降低的趋势。该基因在Ⅰ期卵巢中的表达量最高,且显著高于其它各期卵巢,其次是Ⅱ和Ⅲ期卵巢,Ⅱ期和Ⅲ期卵巢中的表达量显著高于Ⅳ、Ⅴ和Ⅵ期卵巢,Ⅵ期卵巢中MnRPS3a基因表达量最低。
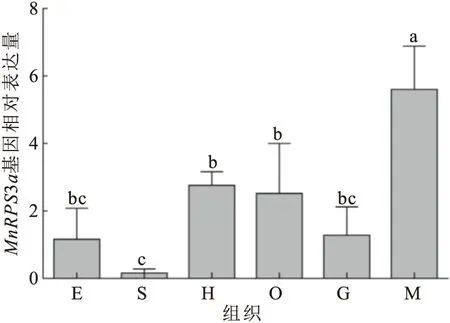
图5 MnRPS3a基因在Ⅰ期卵巢的日本沼虾不同组织中的表达特征Fig.5 MnRPS3a gene expression in different tissues of M.nipponense with stage Ⅰ ovary E:眼柄;
S:胃;
H:肝胰腺;
O:卵巢;
G:鳃;
M:肌肉;
不同小写字母表示差异显著(P<0.05)。下图同。
2.5 5-HT和DA刺激对卵巢组织中MnRPS3a与Vg基因表达的影响
如图7A所示,注射5-HT 24 h后,MnRPS3a表达量与对照组相比显著增加,注射5-HT 48、72和96 h后,MnRPS3a表达量与对照组相比极显著增加。整体来看,注射5-HT后,卵巢中MnRPS3a表达量呈逐渐上升趋势;
注射DA 48 h后,MnRPS3a在日本沼虾卵巢中的表达量与对照组相比极显著降低(P<0.01),注射DA 72和96 h后,MnRPS3a表达量与对照组相比显著降低。5-HT和DA注射后Vg基因表达变化见图7B。注射5-HT 48 h后,Vg基因表达量与对照组相比显著增加,注射5-HT 72和96 h后,Vg基因表达量与对照组相比极显著增加。整体来看,注射5-HT后,卵巢中Vg基因表达量与MnRPS3a表达量一致,也呈现出逐渐上升的趋势;
注射DA 72和96 h后,Vg基因表达量与对照组相比分别显著和极显著降低。

图6 MnRPS3a基因在日本沼虾不同发育阶段的卵巢中的表达特征Fig.6.MnRPS3a gene expression in different ovarian development stages of M.nipponenseⅠ:Ⅰ期卵巢;
Ⅱ:Ⅱ期卵巢;
Ⅲ:Ⅲ期卵巢;
Ⅳ:Ⅳ期卵巢;
Ⅴ:Ⅴ期卵巢;
Ⅵ:Ⅵ期卵巢。
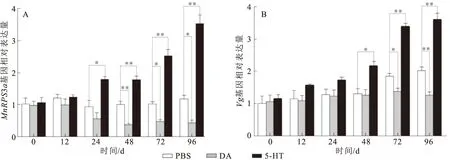
图7 注射5-HT和DA后MnRPS3a(A)和Vg(B)基因在日本沼虾卵巢中的相对表达量Fig.7 Relative expression levels of MnRPS3a(A) and Vg(B) genes in ovary after M.nipponense were injected with 5-HT and DA“*”表示显著性差异(P<0.05),“**”表示极显著性差异(P<0.01)。
2.6 MnRPS3a蛋白在日本沼虾卵巢组织中的定位
HE染色及IF检测结果(图8)显示,日本沼虾Ⅰ期卵巢中大部分为卵原细胞,少部分为卵黄生成前期卵母细胞(图8-a),Ⅱ期卵巢中主要为卵黄生成前期卵母细胞(图8-b),Ⅰ期和Ⅱ期卵巢的卵原细胞和卵母细胞中均无MnRPS3a蛋白合成信号,而它们周围的滤泡细胞中显示出MnRPS3a蛋白的高活性合成信号(图8-f,8-g);
Ⅲ期卵巢中主要为卵黄生成期卵母细胞,卵黄颗粒位于卵母细胞细胞质的外围(图8-c),而在卵黄颗粒生成的部位即卵母细胞细胞质的外围显示出MnRPS3a蛋白的高活性合成信号(图8-h);
Ⅳ期卵巢中主要为卵黄生成后期卵母细胞,卵黄颗粒几乎遍布整个卵母细胞的细胞质(图8-d),MnRPS3a蛋白的合成信号也遍布Ⅳ期卵巢卵母细胞的细胞质,但合成信号较弱(图8-i);
Ⅴ期卵巢中主要为成熟期的卵母细胞,卵黄颗粒也几乎布满整个卵母细胞的细胞质(图8-e),但整个细胞中都没有检测到MnRPS3a蛋白的合成信号(图8-j)。
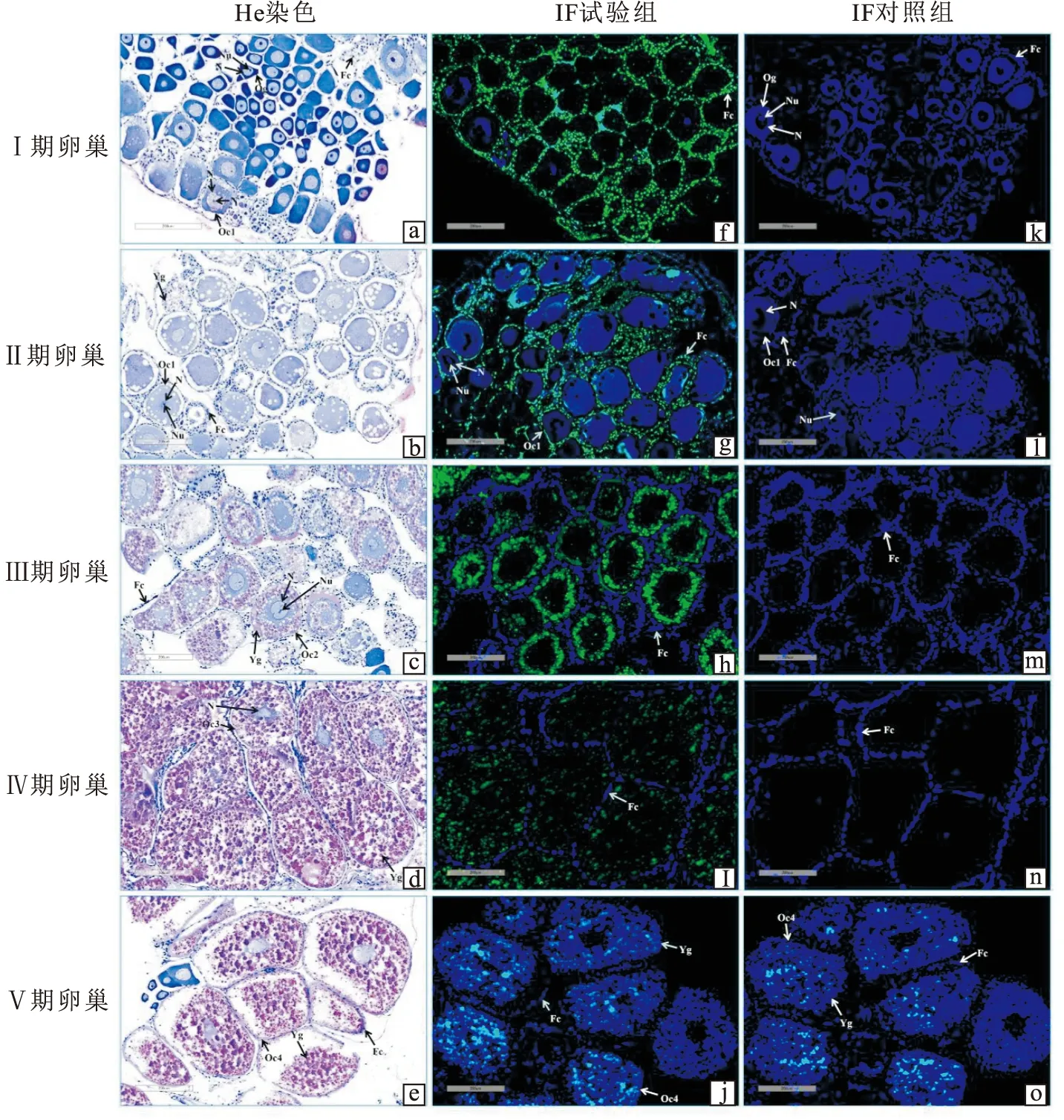
图8 卵巢组织切片观察及Ⅰ-Ⅴ期卵巢中MnRPS3a蛋白定位的IF检测Fig.8 Observation of ovarian tissue sections and IF detection of MnRPS3a protein localization in ovaries at stage Ⅰ-Ⅴ
了解与性腺发育相关基因的功能与作用对于控制日本沼虾的生殖发育至关重要。一些报道表明核糖体蛋白基因在生物体的卵巢发育中具有重要作用,例如小鼠(Musmusculus)卵母细胞中Rps26基因敲除会导致卵泡从窦前卵泡到窦卵泡的发育迟缓,最后导致卵母细胞死亡和卵巢早衰[15];
褐稻虱(Nilaparvatalugens)RPL5基因被RNA干扰后阻滞了其卵巢发育,并减少了其产卵量[16];
用墨吉对虾重组RPL10a蛋白孵育其卵巢外植体会刺激卵巢成熟相关基因表达[17],且墨吉对虾活体注射重组RPL10a蛋白后会促进其卵黄生成和早期卵巢发育[18];
RPL24基因在日本沼虾卵巢早期发育阶段高表达,该基因表达被RNAi沉默后其卵巢发育被延迟,产卵率下降[19],克氏原螯虾RPS24基因在其Ⅰ期卵巢中的表达量最高,其次是Ⅱ期和Ⅳ期卵巢,可能与其卵原细胞分化和卵母细胞成熟分裂的启动有关[20]。为进一步研究核糖体蛋白家族基因对日本沼虾卵巢发育的作用,本研究从日本沼虾卵巢中克隆得到了MnRPS3a基因,并对其功能进行了初步的探究。
3.1 MnRPS3a基因序列与系统进化分析
本研究中,MnRPS3a基因以及其他无脊椎动物RPS3a基因所编码的氨基酸序列的C端均具有一个核定位信号。以往的研究表明墨吉对虾RPL10a[17]和日本沼虾RPL24[19]氨基酸序列中也具有核定位信号,说明这些核糖体蛋白均是在细胞质中合成,然后在核定位信号的指引下进入细胞核的核仁处与rRNA一起进行组装,装配形成的核糖体再从细胞核的核孔进入细胞质中发挥作用,这与它们作为一种核糖体的结构蛋白而参与蛋白质生物合成的基本作用是一致的。将MnRPS3a与其他生物RPS3a氨基酸序列进行比对和系统进化分析,发现它与同为十足目甲壳动物墨吉对虾RPS3a氨基酸序列相似性最高,亲缘关系也最近,并在进化树上与无脊椎动物RPS3a聚于一支,这些研究结果都与日本沼虾的分类地位相一致。
3.2 MnRPS3a基因表达分析
核糖体蛋白基因转录在机体的各组织中广泛分布。在无脊椎动物的研究中,褐稻虱RPL5基因[16]和日本沼虾RPL24基因[19]在所检测的各种组织中均有表达,但均在卵巢组织中表达量最高。本研究中,MnRPS3a基因也在所检测的日本沼虾的8个组织中均有分布,这与以上研究结果一致,说明这些核糖体蛋白基因为非组织特异性基因。但在本研究中,MnRPS3a基因在日本沼虾肌肉组织中的表达量最高,然后是肝胰腺,再次为卵巢,这又与以上研究结果不一致,说明不同的核糖体蛋白在不同物种的组织分布具有一定的差异性。在不同发育阶段的卵巢组织中,MnRPS3a在Ⅰ期卵巢中的表达量最高,并随着卵巢发育其表达量逐渐降低,说明该基因在日本沼虾早期卵巢发育阶段起较大作用。研究表明墨吉对虾RPS3a[10]、日本沼虾RPL24[19]和克氏原螯虾(Procambrusclarkii)RPS24基因[20]均在卵巢发育的早期阶段高表达,在卵巢发育晚期阶段表达量较低。本研究结果与以上研究结果一致,推测MnRPS3a蛋白可能与墨吉对虾RPS3a、日本沼虾RPL24和克氏原螯虾RPS24蛋白一样,是一种早期卵巢发育的刺激因子。
3.3 MnRPS3a基因的功能分析
研究表明,5-HT和DA对甲壳动物卵巢发育具有重要的作用。例如,5-HT会促进淡水蟹Travancorianaschirnerae、BarytelphusaGuerini和克氏原螯虾的卵巢发育,而DA则会抑制它们的卵巢发育[12-14]。甲壳动物卵巢发育过程伴随着卵黄的不断生成,卵黄不仅是卵子的重要结构成分,还是甲壳动物胚胎发育的重要能量和营养来源。甲壳动物卵黄的主要成分为卵黄蛋白(Vn),其前体为卵黄蛋白原(Vg)。甲壳动物Vg合成的位置存在争议,一种认为Vg是由卵巢以外的器官(肝胰腺和脂肪体等)合成,然后通过卵黄蛋白原受体(Vgr)介导的内吞作用从血淋巴带入卵母细胞[21,22],还有一种认为Vg是在卵巢内产生的[23,24]。然而,也有研究表明,日本沼虾[2]和克氏原螯虾[25]等的肝胰腺和卵巢都是Vg的合成部位。本研究中,日本沼虾注射5-HT后24~96 h的卵巢中MnRPS3a表达量和注射5-HT后48~96 h的Vg基因表达量与对照组相比显著升高;
而在注射DA后48~96 h的卵巢中MnRPS3a的表达量和注射DA后72~96 h的Vg基因表达量与对照组相比显著降低。由于随着5-HT和DA注射后卵巢中MnRPS3a基因表达升高和降低,Vg基因的表达量也升高和降低,推测MnRPS3a可能通过调控Vg的合成而参与日本沼虾卵黄的生成作用,从而在其卵巢发育过程中起重要作用。
本研究IF检测结果也表明MnRPS3a蛋白可能参与卵黄颗粒的形成。研究表明,滤泡细胞参与无脊椎动物卵巢发育过程中多种蛋白的合成并转运至卵母细胞[26-28]。本研究中Ⅰ和Ⅱ期卵巢组织滤泡细胞中有很强的MnRPS3a蛋白合成信号,这可能是由于Ⅰ和Ⅱ期卵巢组织分别主要由卵原细胞和卵黄生成前期卵母细胞组成,卵黄颗粒尚未生成,这时在滤泡细胞中大量合成MnRPS3a蛋白,然后再转运入卵母细胞,从而为随后卵母细胞中卵黄颗粒蛋白的形成需要大量的核糖体做准备;
对泥蚶(Tegillarcagranosa)[29]和糙海参(Holothuriascabra)[30]的卵母细胞超微结构研究表明,卵黄生成期的卵母细胞细胞质中的粗面内质网、高尔基体、线粒体、核糖体等多种细胞器参与卵黄的合成,且核糖体密集分布在胞质中。而MnRPS3a蛋白合成信号定位于Ⅲ期卵巢卵母细胞细胞质的外周和Ⅳ期卵巢卵母细胞的整个细胞质中,即定位于这两期卵巢中的卵母细胞的卵黄颗粒的生成部位,由此推测MnRPS3a蛋白可能用于合成大量的核糖体从而参与卵黄颗粒蛋白的生成;
Ⅴ期卵巢中卵母细胞已完全成熟,不再需要卵黄颗粒的生成,同时MnRPS3a蛋白的合成信号也消失。本研究中,MnRPS3a蛋白的合成信号基本上是随着卵巢从Ⅰ期到Ⅴ期的发育由强逐渐变弱,这与MnRPS3a基因在日本沼虾不同发育阶段的卵巢中的表达特征基本一致。但日本沼虾MnRPS3a蛋白与卵巢中卵黄的生成有关的推测还需进一步的研究验证。
综上所述,本研究克隆得到了日本沼虾MnRPS3a基因的全长cDNA序列,通过其表达分析和蛋白的定位分析,推测MnRPS3a基因可能直接或间接参与日本沼虾卵巢中卵黄的生成从而对其卵巢发育进行调控,并在其早期卵巢发育阶段起重要的作用,但其具体作用的分子机制还需进一步的研究确定。
猜你喜欢发育阶段沼虾核糖体核糖体成熟因子RimP、Era和RimJ的研究进展内蒙古民族大学学报(自然科学版)(2022年2期)2022-11-22罗氏沼虾越冬养殖试验当代水产(2022年7期)2022-09-20成功率超70%!一张冬棚赚40万~50万元,罗氏沼虾今年将有多火?当代水产(2022年6期)2022-06-29小麦生殖发育阶段对低温的敏感性鉴定作物学报(2022年7期)2022-05-11罗氏沼虾高效生态养殖技术当代水产(2021年8期)2021-11-04核糖体生物合成与肿瘤的研究进展肿瘤防治研究(2020年5期)2020-07-09例析翻译过程中核糖体移动方向的判断生物学教学(2019年9期)2019-09-23“茜草+温棚”高要罗氏沼虾养殖新模式 中国罗氏沼虾之乡养殖面积3.6万亩海洋与渔业(2017年11期)2018-01-26对森工林区在商品林基地培养速生杨树探讨科学与财富(2017年26期)2017-09-23大花黄牡丹叶片发育过程中气孔密度和气孔指数的动态变化江苏农业科学(2014年9期)2014-11-15上一篇:辣椒新品种优美885,的选育
