基于类器官培养的艰难梭菌毒素B损伤结肠上皮机制的初步研究
吕 婷, 王 莉, 赵 冰, 黄海辉
艰 难 梭 菌(Clostridioides difficile) 是 革 兰阳性厌氧产芽孢杆菌, 25%~33%的抗生素相关性腹泻以及90%的伪膜性肠炎都由艰难梭菌所致,此类感染统称为艰难梭菌感染(Clostridioides difficileinfection, CDI)[1]。目前认为艰难梭菌主要通过分泌毒素而引发感染,其中艰难梭菌毒素B(Clostridioides difficiletoxins B,TcdB)在致病过程中占据主要地位,体外机制研究主要在细胞模型如Caco2细胞、NCM 460细胞中进行[2-3]。类器官是体内的多能干细胞在体外培养形成的三维细胞集合,模拟体内器官的空间结构和功能。肠道类器官模型比传统的体外细胞模型具有明显优势,模拟了肠道的复杂细胞结构特性,提供了在体外系统中探索宿主与病原体相互作用的独特平台。尽管结肠类器官模型取得了很大进展,并且已经使用这种类器官系统开展了结肠癌发病机制及药敏方面的研究,但用于CDI研究较为少见[4]。本研究拟通过构建小鼠结肠类器官模型,对艰难梭菌毒素损伤结肠上皮的致病机制进行初步研究。
1.1 实验材料
1.1.1 材料来源 实验动物为6~8周雄性野生型C57BL/6 SPF级小鼠,购自上海斯莱克实验动物有限公司。表达重组TcdB(recombinant TcdB,rTcdB)的巨大芽孢杆菌菌株由美国马里兰大学冯汉平教授惠赠。
1.1.2 主要仪器与试剂 乙二胺四乙酸(EDTA)(美国ThermoFisher Scientific公司)、基质胶(美国corning公司)、总RNA提取试剂盒[天根生化科技(北京)有限公司]、GoScriptTM试剂盒(美国Promega公司)、SYBR Green qPCR Master Mix(美国Bimake公司)。
3D类器官培养组分:Advanced DMEM/F12、penicillin/streptomycin、glutamax、N2 supplement和 B27 supplement均购自美国Gibco公司,N-acetylcysteine 和Nicotinamide 均购自美国Sigma-Aldrich公司,A83-01、 Rho kinase (ROCK)inhibitor (Y-27632))和前列腺素E2(PGE2)均购自美国MedChemExpress公司,重组 Wnt 3a 蛋白 、重组 R-Spodin 1 蛋白和重组 Noggin 蛋白均购自中国德州奥格锐生生物科技有限公司,表皮生长因子重组蛋白(EGF)(美国ThermoFisher Scientific 公司),Primocin(美国 Invivogen 公司)。
rTcdB表达用试剂:LB培养基(胰蛋白胨、酵母提取物、氯化钠、5 mg/L四环素,均购自上海生工公司);
木糖(上海生工公司);
HisTrap HP柱(美国General Electric Company公司);
透析卡(美国ThermoFisher Scientific公司);
100 kDa超滤管(美国Millipore公司)。
1.2 实验方法
1.2.1 鼠结肠类器官培养体系 在Miyoshi等[5]建立的培养体系上略作修改,将N2 supplement(1×)、B27 supplement( 1×)、glutamax(1×)、penicillin/streptomycin(1×)、N-Acetylcysteine(1.25 mmol/L)、EGF(50 μg/L)、Noggin(100 μg/L)、Wnt-3a(50 μg/L)、R-Spodin-1(1 mg/L)、A83-01(1 μmol/L)、Y-27632(10 μmol/L)、PGE2(10 nmol/L)、Nicotinamide(10 mmol/L)、Primocin( 100 mg/L)加至1L Advanced DMEM/F12中,混匀后经0.22 μm除菌滤器过滤后备用。
1.2.2 小鼠结肠上皮隐窝分离和培养 颈椎脱臼处死C57BL/6小鼠,75%乙醇喷洒消毒,“Y”字剪开腹腔将回盲部后的6~8 cm的结肠肠段取出;
剪开并刮除结肠黏膜面的粪便和黏液;
清洗鼠结肠组织5~10 min至洗涤液澄清,用剪刀剪成大约2~3 mm的肠块,置于5 mmol/L EDTA溶液中,4℃消化35 min。将结肠组织碎片置于含有5 mL DPBS的15 mL离心管中,剧烈摇晃,用基质胶重悬,铺至48孔细胞板中,37℃10~30 min后加入鼠结肠类器官培养体系,37℃、5% CO2细胞培养箱培养,每2~3 d换新的培养体系,连续培养5~7 d,观察、拍照并记录倒置显微镜下类器官生长情况。
1.2.3 鼠结肠类器官传代和培养 弃去原培养体系,用1 mL枪头将基质胶吹打成碎片,1 400 r/min离心2 min,取沉淀加入含2 mmol/L EDTA的DPBS混匀再1 200 r/min离心5 min,沉淀即为类器官; 用基质胶重悬类器官沉淀后,垂直接种于48孔培养板中,待胶凝固后加入新培养体系培养。
1.2.4 rTcdB制备 将表达rTcdB的巨大芽孢杆菌接种于LB培养基中,经木糖诱导12~14 h后超声破菌,获得的菌体裂解液经HisTrap HP柱纯化;
纯化后得到的蛋白使用透析卡磁力搅拌过夜,透析卡中的蛋白用100 kDa超滤管超滤浓缩,得到高纯度的蛋白。
1.2.5 建立TcdB损伤结肠类器官模型 取稳定传代培养的结肠类器官接种于48孔板,设置rTcdB的浓度为:5 pmol/L、10 pmol/L,每个浓度设置3个复孔,然后分别加入含上述rTcdB浓度梯度的鼠结肠类器官培养液,以不含rTcdB处理的结肠类器官作阴性对照,置于37°C、5 %CO2培养箱中培养。12 h、24 h后在倒置显微镜下观察类器官的生长情况。
1.2.6 采用总RNA提取试剂盒 提取对照组和损伤组RNA,提取产物的D260/D280比值1.8~2.0;
采用反转录试剂盒合成第一链cDNA;
以编码磷酸甘油醛脱氢酶的GAPDH 基因作为内参基因(GAPDH 正向引物序列为5"-CATGGCCTTCCGTGTTCCTA-3", 反 向 引 物 序列 为 5"- CCTGCTTCACCACCTTCTTGAT-3"),Lgr5基因正向引物序列为5"- CGGGACCTTGAAGATTTCCT-3",反向引物序列为5"-AGCAGGCCGTTCACAACATC-3",Axin2基因正向引物序列为5"-GCTCCAGAAGATCACAAAGAGC-3’, 反 向引物序列为5"-AGCTTTGAGCCTTCAGCATC-3",Bmi1基因正向引物序列为5"-AAATCCCCACTTAATGTGTGTCC-3",反向引物序列为5"-CTTGCTGGTCTCCAAGTAACG-3"。
取稀释后的反转录产物1 μL,采用 SYBR Green 试剂盒对cDNA进行实时荧光定量聚合酶链反应(qRT-PCR),引物序列同上。qRT-PCR 体系包括 SYBR®Premix Ex Taq(2×)5 μL、cDNA 1 μL、上游引物0.5 μL、下游引物0.5 μL、去离子水3 μL,条件为95 ℃预变性 3 min,95℃ 30 s、95℃ 5 s、60℃ 34 s(40个循环)、72℃ 30 s。重复3次取平均值。采用 2-ΔΔCt法计算上述基因相对表达量。
1.2.7 类器官RNA-seq测序和生物信息学分析 选取对照组和rTcdB 5 pmol/L处理12 h后的艰难梭菌毒素损伤组的类器官样本,提取RNA后将样本送至北京贝瑞公司进行RNA-seq测序。edgeR软件筛选差异基因,DAVID网站进行基因本体论(Gene Ontology, GO) 和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG) 通路富集分析,对筛选出的差异基因导入到STRING数据库(https://stringdb.org/)中进行蛋白互作网络(Protein Protein Interaction Network, PPI)分析,将得出的结果导入Cytoscape(3.9.1)得到可视化网络,分别利用Cytoscape中的MCODE和CytoHubba插件对网络进行拓扑分析,筛选关键基因(Hub gene),MCODE算法取得分最高的集合,CytoHubba中我们采用最常用的MCC算法,取前10位的基因集合,两种算法的集合作为最终Hub gene的选择。
1.3 统计学分析
样品基因表达量采用t检验分析,P值<0.05为差异有统计学意义。
2.1 原代鼠结肠3D类器官构建成功及可稳定传代培养
小鼠C57BL/6的结肠隐窝包埋在基质胶培养,第0天为长条形,次日可形成单层细胞球结构,在连续 7 d的培养过程中隐窝逐渐闭合,体积逐渐增大,形成圆球状的复杂立体结构,鼠结肠类器官体外构建成功[5-6]。构建的类器官可连续增殖传代10代(图1)。
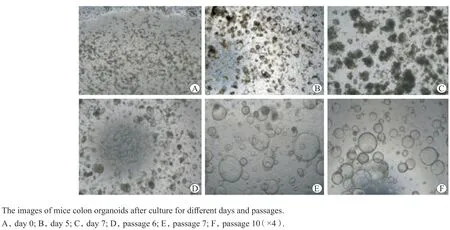
图1 鼠结肠类器官构建和传代Figure 1 The construction and passage of mice colon organoid
2.2 TcdB损伤结肠类器官模型
借鉴Tao等[6]、Saavedra等[7]的实验方案,100 pmol/L rTcdB加入到结肠类器官中,导致类器官全部死亡,后采用5 pmol/L和10 pmol/L rTcdB分别处理结肠类器官24 h和48 h,结果发现二者在作用24 h时均可使类器官生长缓慢及部分死亡,10 pmol/L rTcdB 作用48 h时类器官死亡最为明显,此系列浓度的选择也与Alonso等[8]发表的人结肠内TcdB毒素浓度相近(图2)。考虑到rTcdB为5 pmol/L时即可损伤类器官,为此我们选择5 pmol/L为后续实验浓度,并将作用时间设置为12 h和24 h,结果显示相较于对照组,损伤组类器官体积相对较小,状态相对较差,作用12 h类器官状态好于24 h(图2)。同时收取类器官样本检测数个代表性的干性基因表达情况,结果显示损伤组Lgr5、Axin2、Bmi1表达显著上调(图3)。为了进一步研究TcdB作用机制,我们选取5 pmol/L rTcdB组和对照组作用12 h时的样本进行RNA-seq分析。

图2 rTcdB (5 pmol/L、10 pmol/L)损伤鼠结肠类器官12 h、24 h、48 hFigure 2 Injury of mice colon organoids after addition of rTcdB (5 pmol/L, 10 pmol/L) for 12 h, 24 h, and 48 h

图3 rTcdB (5 pmol/L)感染鼠结肠类器官12 h和24 h基因表达Figure 3 Relative expression of genes in mice colon organoids after being infected by rTcdB (5 pmol/L) for 12 h and 24 h
2.3 差异基因表达水平分析
根据样本基因表达水平不同,筛选出损伤组和对照组之间的差异表达基因,以|log2Fold Change|>1,P<0.05为筛选条件,共筛选出差异基因3 140个,与对照组相比,损伤组表达上调基因有1 936个,下调基因有1 204个,使用火山图展示差异基因的分布情况(图4A)。
2.4 差异基因的GO分析
根据差异基因的结果,利用GO富集分析对转录组数据进行功能注释,GO分析结果表明,在生物过程(biological progress, BP)中富集了244个功能,在细胞组成(cellular component, CC)中富集了54个功能,分子功能(molecular function,MF)中富集了72个功能。其中损伤组上调基因主要涉及的BP通路有低氧应答、跨膜转运和上皮细胞分化等,图4B列出了BP、CC和MF的前10个富集通路。损伤组下调基因涉及的BP通路包括细胞增殖正向调控、免疫系统过程、对γ干扰素的细胞应答、对β干扰素的细胞应答和细胞迁移的正向调节等(图4C)。

图4 差异基因的火山图和GO分析Figure 4 Volcano plot and GO analysis of differentially expressed genes
2.5 差异基因的KEGG分析
KEGG分析结果表明,共有47条通路显著富集,其中损伤组上调基因涉及通路主要与视黄醇代谢、胆汁分泌、花生四烯酸代谢和ABC转运体等相关(图5A);
损伤组下调基因涉及通路主要包括Wnt信号通路、细胞黏附模块、肿瘤坏死因子信号通路和转化生长因子-β信号通路等(图5B)。其中,细胞黏附模块中CLDN1和CLDN10为黏膜屏障的代表性基因,二者表达在损伤组中均显著下调。

图5 差异基因的KEGG分析Figure 5 KEGG analysis of differentially expressed genes
2.6 差异基因编码蛋白质的PPI分析
蛋白之间通常通过相互作用结合成复合物行使相应的功能,具有相互作用的差异基因通常具有相似的功能。采用Cytoscape的MCODE和CytoHubba(MCC算法)分别筛选出重要基因作图,结果见图6。二者模块的基因集取交集得到的基因作为关键基因,分别编码IFI44、IFIT3、IFIT1、RTP4、CXCL10、GBP3、GBP2、RSAD2 和 IFI47的基因,关键基因的表达在损伤组中均为下调。其中IFIT3、IFIT1、GBP3和GBP2与α/β干扰素、γ干扰素的细胞应答相关。

图6 关键基因Figure 6 Hub genes
本研究运用结肠类器官构建了TcdB损伤结肠上皮的模型,TcdB可以导致结肠类器官生长缓慢及死亡,多个代表性干性基因(stemness-related genes)表达发生显著改变。并利用RNA-seq技术从整体水平上研究正常结肠类器官组和损伤组的基因转录水平,结果显示正常结肠类器官组和损伤组之间存在着多种差异基因的上调和下调,涉及多种细胞信号和生物学过程。
GO富集分析发现,两组在多个通路中均富集了大量的差异基因,说明TcdB对结肠类器官的作用是多条途径相互作用的结果。上调基因富集通路有低氧应答,与以往临床报道CDI导致肠道内缺氧、低灌注相符[9]。下调基因富集的通路有对β、γ干扰素的细胞应答。同时,PPI分析中得到的9个关键基因,其中的Ifit3、Ifit1、Gbp3和Gbp2参与了α/β干扰素以及γ干扰素等信号通路的调节,在TcdB对结肠上皮细胞的作用中起到了关键作用。除了细菌因素外,宿主免疫反应也是CDI严重程度的关键因素[10],目前对干扰素研究主要集中在γ干扰素上,Abt等[11]报道了γ干扰素在小鼠CDI中具有保护作用,McDermott等[12]随后报道了γ干扰素是通过独立于炎性细胞因子表达和粒细胞募集的机制在艰难梭菌结肠炎中起保护作用,但其详细机制仍未完全阐明。近期Hamo等[13]通过测定CDI患者血清样本细胞因子和趋化因子的浓度,首次报道了α干扰素与严重CDI密切相关。本研究同样发现除了γ干扰素外,α/β干扰素也参与了艰难梭菌的致病过程,且与α/β干扰素相关的基因在整个致病过程中低表达,这为后续探索艰难梭菌致病机制提供了新方向。
在KEGG通路分析中特别引起注意的是花生四烯酸代谢通路相关基因表达上调。有文献报道,TcdB通过上调磷脂酶A2(Phospholipase A2)的表达,促进14-碳-花生四烯酸的表达[14-15]。虽然目前研究者仅报道了TcdA对肠道的损伤可能由内源性大麻素花生四烯酸乙醇胺介导[16],但鉴于TcdA和TcdB结构上一定相似性,TcdB对上皮的损伤也可能与花生四烯酸相关。在下调基因涉及的通路富集中,Wnt通路和细胞黏附模块中富集的基因表达明显。Tao等[6]提出TcdB与结肠上皮细胞的Wnt信号通路受体Frizzleds结合起作用,Wnt信号通路的减弱直接损害结肠上皮细胞的增殖,另外,细胞黏附模块中的CLDN1和CLDN10为黏膜屏障的代表性基因,其在损伤组中的表达较对照组显著下调,研究显示TcdB会破坏肠道紧密连接,导致黏膜屏障受损[17]。
综上所述,本研究通过构建TcdB感染鼠结肠类器官模型,筛选出了与感染密切相关的通路,发现TcdB可能通过调节干性基因表达,增强低氧应答通路,减弱α/β干扰素、γ干扰素的细胞应答通路,调节花生四烯酸代谢通路和Wnt信号通路来介导毒素损伤结肠上皮细胞。为深入探究艰难梭菌致病机制提供了新思路。后期将针对差异基因的筛选结果验证后开展进一步研究,探讨艰难梭菌毒素损伤结肠上皮细胞的机制。
猜你喜欢差异基因梭菌干扰素丁酸梭菌的筛选、鉴定及生物学功能分析中国饲料(2021年17期)2021-11-02基于RNA 测序研究人参二醇对大鼠心血管内皮细胞基因表达的影响 (正文见第26 页)心电与循环(2020年1期)2020-02-27紫檀芪处理对酿酒酵母基因组表达变化的影响江苏农业科学(2017年5期)2017-04-15猪肉毒梭菌中毒症的发生和诊疗方法兽医导刊(2016年6期)2016-05-17α-干扰素联合利巴韦林治疗慢性丙型肝炎中国继续医学教育(2015年6期)2016-01-07雾化吸入γ干扰素对免疫低下肺炎的疗效观察哈尔滨医药(2015年6期)2015-12-01西藏牦牛肉毒梭菌中毒病的防治西藏科技(2015年10期)2015-09-26干扰素α-1b治疗成人麻疹疗效初步观察中国医疗美容(2015年2期)2015-07-19SSH技术在丝状真菌功能基因筛选中的应用湖北农业科学(2014年3期)2014-07-21恩替卡韦治疗干扰素失败的慢性乙型肝炎72例疗效观察河南医学研究(2014年4期)2014-02-27