2022版美国儿科学会新生儿高胆红素血症管理指南解读
杨静丽 王建辉
(重庆医科大学附属儿童医院新生儿诊治中心/国家儿童健康与疾病临床医学研究中心/儿童发育疾病研究教育部重点实验室/儿科学重庆市重点实验室,重庆 400014)
新生儿高胆红素血症是新生儿期最常见的疾病之一,严重患儿可遗留长期神经系统后遗症[1-2]。为快速有效干预新生儿高胆红素血症,避免胆红素脑病的发生,2004年美国儿科学会(American Academy of Pediatrics,AAP) 制定了胎龄≥35周新生儿黄疸诊疗指南(以下简称“2004版AAP指南”)[3]。2014年中华医学会儿科学分会新生儿学组制定了《新生儿高胆红素血症诊断和治疗专家共识》(以下简称“2014版国内共识”)[4]。2022年9月,AAP在总结过去18年循证证据的基础上,第一次对2004版AAP指南进行了更新(以下简称“2022版 AAP指南”)[5]。现就 2022版AAP指南中与新生儿黄疸诊疗相关的要点进行解读,并与2004版AAP指南及2014版国内共识做一对比。
1.1 高危因素的评估
2022版AAP指南再次强调每个新生儿生后均应进行高胆红素血症高危因素的评估,与2004版AAP指南不同的是,新的指南更简单易实施,取消了主要、次要高危因素的分层,也较2014版国内共识内容更全面。2022版指南所列的高胆红血症高危因素包括:(1)较低胎龄(胎龄<40周时,风险随胎龄的减少而逐渐升高);
(2)生后24 h内出现黄疸;
(3)产科出院前胆红素测量值[经皮胆红素 (transcutaneous bilirubinometry,TcB)/血清或血浆总胆红素(total serum bilirubin,TSB)]接近光疗阈值;
(4)明确的各种原因引起的新生儿溶血,或因胆红素增长过快而考虑溶血可能[日龄≤24 h时,增加速度≥0.3 mg/(dL·h);
日龄>24 h,增加速度≥0.2 mg/(dL·h)];
(5)产科出院前新生儿已接受光疗;
(6)父母或兄弟姐妹有光疗或换血的既往史;
(7)有遗传性红细胞疾病(如葡萄糖-6-磷酸脱氢酶缺乏症)家族史;
(8)纯母乳喂养且摄入不足;
(9)头皮血肿或明显瘀伤;
(10)唐氏综合征;
(11)糖尿病母亲分娩的巨大儿。
2022版AAP指南强调高胆红素血症神经毒性高危因素的正确评估,如存在神经毒性高危因素需降低光疗阈值及升级治疗的水平。2022版AAP指南取消了窒息、嗜睡、体温不稳定、酸中毒等情况,新增了生后24 h内临床状况不平稳,强调临床医生对病情判断的灵活性及重要性。2022版AAP指南中高胆红素血症神经毒性高危因素包括:(1)胎龄<38周(胎龄越小风险越高);
(2)白蛋白<3.0 g/dL;
(3)任何原因引起的溶血性疾病(包括免疫性溶血性疾病、葡萄糖-6-磷酸脱氢酶缺乏症或其他溶血性疾病);
(4)新生儿败血症;
(5)生后24 h内临床状况不平稳。
1.2 高胆红素血症的监测
TSB长期以来作为诊断高胆红素血症的“金标准”,在高胆红血症的风险评估、指导光疗或换血干预决策中起着重要作用。TcB是无创检测胆红素的重要手段,实现了临床胆红素变化的无创动态监测,但容易受肤色的影响。尽管如此,TcB与TSB之间仍有较好的相关性[6-7],研究显示当TSB<15 mg/dL时,两者差值通常在3 mg/dL以内[8]。使用TcB筛查可以筛选出需进一步完善TSB检测的新生儿,以减少临床不必要的采血。
胆红素的视觉评估是通过临床体格检查观察黄疸范围来估计胆红素的水平。2022版AAP指南指出,日龄≥3 d的足月新生儿黄疸干预阈值较高,视觉评估容易将需要治疗的黄疸与轻度黄疸相鉴别[9-10]。然而,与白种人群相比,黄种人群的视觉评估与TcB或TSB存在差异的可能更大[11],因此笔者建议国内有条件的医疗机构需对每位新生儿在7日龄前至少进行每日一次的TcB筛查,必要时完善TSB检测。
同2004版AAP指南一致,所有新生儿在产科出院前建议每12 h进行一次胆红素视觉评估,生后<24 h出现肉眼可见黄疸的新生儿,应尽快完善TSB或TcB。2022版AAP指南强调其他新生儿在出生后24~48 h或产科出院前应进行至少一次TSB或TcB检测。当TcB超过光疗阈值或在阈值3 mg/dL范围内,或≥15 mg/dL时,则建议完善TSB检测。若有两次及以上的TcB或TSB连续监测,可通过胆红素的升高速度来评估后续发生高胆红素血症的风险[12]。如生后24 h内,胆红素升高≥0.3 mg/(dL·h),或24 h内升高≥0.2 mg/(dL·h),则尽快完善直接抗球 蛋 白 试 验 (direct antiglobulin test, DAT)检测[13]。
2022版指南及2004版指南均建议如母乳喂养的新生儿生后3~4周或配方奶喂养的新生儿生后2周仍有黄疸,应测量TSB及直接(或结合)胆红素水平,以明确有无胆汁淤积。2022版AAP指南指出直接胆红素和结合胆红素的细微差别,直接胆红素表示能和偶氮试剂直接反应的胆红素,包括结合胆红素、大部分δ-胆红素及少部分非结合胆红素,并建议将直接胆红素浓度>1.0 mg/dL或结合胆红素≥0.3 mg/dL定义为异常[14-15]。结合胆红素大于TSB的20%已不再认为是诊断胆汁淤积的必备条件[14]。直接或结合胆红素水平增高提示有病理性胆汁淤积的可能,需进一步完善相关检查以明确病因,如胆道闭锁、尿路感染、免疫性溶血性疾病、败血症及先天性代谢异常等。
2022版AAP指南较2004版AAP指南、2014版国内共识在干预治疗的阈值方面存在明显区别。新的指南在整理总结近18年有关光疗的潜在危害及提高干预阈值安全性的新证据后,将光疗及换血的干预阈值整体提高了一个安全的范围,并且根据有无高胆红素血症神经毒性高危因素将干预阈值进行了差异化设置,旨在安全地降低胆红素脑病的风险及不必要的干预[16]。同时,新的指南将不同胎龄的阈值划分得更加详细,更有利于精准化治疗。
2.1 光疗
2.1.1 光疗的时机 光疗的主要目的是避免TSB进行性升高,减少换血治疗风险。新的证据显示当胆红素浓度远高于2004版AAP指南的换血阈值时,才有可能发生胆红素脑病[17-18]。另外,越来越多的证据显示光疗可能有少见但严重的晚期不良反应(如过敏、癫痫、癌症等)[19-21]。因此,为避免过度光疗,将光疗阈值提高一个小的范围是安全合理的,但需同时强调住院期间胆红素筛查及出院后随访的重要性。
2022版AAP指南根据有无高胆红素血症神经毒性高危因素、胎龄及生后时龄,绘制了新的光疗阈值图(图1和图2)。由于光疗阈值是基于专家意见,并不是强有力的临床证据,临床医生可根据患儿具体情况及临床偏好选择更低的光疗阈值,以减少再入院的风险,但需评估过度治疗的风险。如新生儿生后早期胆红素上升速度过快,提示后期达到光疗阈值可能性很高,因此在产科住院期间可选择低于阈值的水平开始光疗。
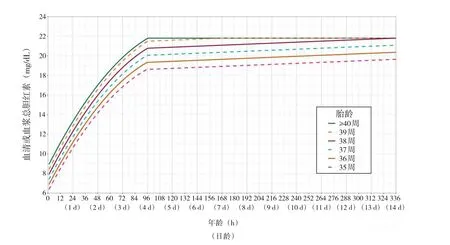
图1 无高胆红素血症神经毒性高危因素新生儿的光疗阈值[5]

图2 有高胆红素血症神经毒性高危因素新生儿的光疗阈值[5]
2.1.2 光疗的选择 光疗的有效性取决于光疗的强度及患儿暴露的表面积(双面蓝光)。标准光疗的辐照度为8~10 μW/(cm2·nm),强光疗的辐照度≥30 μW/(cm2·nm)。当达到 2022 版指南光疗阈值(图1和图2)时,一般使用窄光谱LED蓝光(波长约460~490 nm)的强光疗,在最初24 h可使TSB下降30%~40%,较标准光疗快2~5倍[22]。
2.1.3 光疗的监测 光疗的临床效果一般在干预后4~6 h内显现[23]。2004版AAP指南推荐光疗后4~24 h复测TSB,2014版国内共识推荐光疗后6~12 h复测TSB,对于溶血症或TSB接近换血阈值的患儿建议光疗后4~6 h复测。2022版AAP指南建议光疗患儿应在开始光疗后12 h内复测TSB,具体的初始TSB测量时间及频率应根据新生儿的日龄、有无高胆红素血症神经毒性高危因素、TSB值及变化趋势由临床医生综合判断。选择家庭光疗的新生儿需每天测量TSB,如TSB持续升高且与光疗阈值的差值逐渐缩小,或TSB高于光疗阈值≥1 mg/dL,建议立即住院接受光疗[24]。
2.1.4 停止光疗 停止光疗的决定应充分权衡减少光疗暴露、母婴分离的获益与发生高胆红素血症反弹(停止光疗后72~96 h内TSB再次达到光疗阈值)的风险。2022版AAP指南推荐当TSB降低至光疗阈值2 mg/dL以下可停止光疗,如存在反弹危险因素(生后<48 h开始光疗、溶血性疾病、胎龄<38周、光疗停止时与光疗阈值相比TSB较高、喂养不足及体重增长欠佳、有高胆红素血症及高胆红素血症神经毒性高危因素等),可适当延长光疗时间[25]。
2.1.5 光疗后的随访 光疗后随访在既往的指南及共识中均未给出明确建议。2022版AAP指南表示光疗后随访的时机取决于高胆红素血症反弹的风险,具体随访时间见表1。2022版AAP指南推荐随访胆红素可选择测量TcB。
2.2 照护升级及换血疗法
2.2.1 照护升级 2022版AAP指南提出照护升级的概念,它是指对胆红素升高或迅速增加的新生儿需要进行重症监护,以减少换血治疗风险。照护升级的阈值比换血阈值低2 mg/dL,当新生儿的TSB达到照护升级阈值时,应立即升级照护级别,并尽快将患儿转至能开展换血疗法的新生儿重症监护病房[26]。
照护升级的患儿应立即接受静脉补液及强光疗。2022版AAP指南建议溶血性疾病患儿静脉输注免疫球蛋白(0.5~1 g/kg)需更加谨慎。静脉输注免疫球蛋白可能无法预防Rh溶血病患儿的换血治疗,对非Rh新生儿溶血病(如ABO溶血)的影响尚不明确,且有观察性研究显示静脉输注免疫球蛋白可能与新生儿坏死性小肠结肠炎有关,因此建议当强光疗后TSB升高或接近换血水平(2~3 mg/dL),且无换血条件时可考虑使用[16]。
在照护升级期间应每2 h测量一次TSB,如TSB降至照护升级阈值以下,可考虑按常规光疗处理。
2.2.2 换血疗法 2022版AAP指南根据患儿有无高胆红素血症神经毒性高危因素、胎龄及生后小时龄,制定了新的换血标准(图3和图4)。同时建议继续将胆红素/白蛋白比值(bilirubin to albumin ratio,B/A比值)作为换血决策的参考:如胎龄≥38周无神经毒性高危因素的新生儿B/A比值达8.0,胎龄≥38周伴有至少1项神经毒性高危因素或胎龄35~37周无神经毒性高危因素的新生儿B/A比值达7.2,胎龄35~37周伴有至少1项神经毒性高危因素的新生儿B/A比值达6.8。另外,2022版AAP指南强调如患儿有急性胆红素脑病表现,应立即进行换血疗法。
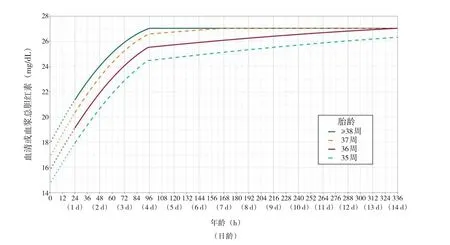
图3 无高胆红血症神经毒性高危因素新生儿的换血阈值[5]

图4 有高胆红血症神经毒性高危因素新生儿的换血阈值[5]
当TSB达到换血阈值时,应立即进行换血准备。如在准备阶段复查TSB低于换血阈值,且患儿无胆红素脑病表现,则应考虑推迟换血,继续强光疗及补液治疗,每2 h复测TSB,直至低于照护升级阈值以下,将按常规光疗处理。
换血疗法推荐选择浓缩的洗涤红细胞与新鲜冰冻血浆混合至红细胞比容约40%。换血治疗清除胆红素的功效与置换血浆中的白蛋白含量直接相关,当红细胞比容接近40%时,混合血中含有较高的白蛋白量,更有利于增加体内胆红素的清除[27]。
与2004版AAP指南使用小时胆红素列线图来评估严重高胆红素血症发生风险不同,2022版AAP指南建议使用胆红素测值与光疗阈值的差异来确定产科出院后随访计划。生后12 h后考虑出院的新生儿,应计算最接近出院时测量的胆红素值与光疗阈值之间的差异,根据图5指导随访,而所有在生后12 h内出院的新生儿均应在生后24~48 h随访胆红素。
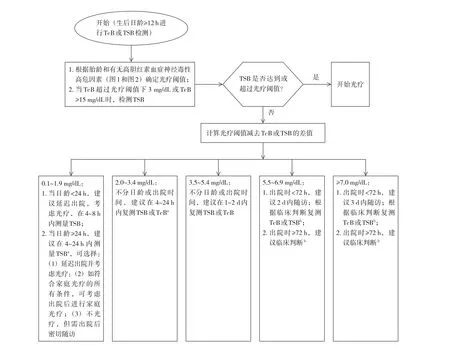
图5 产后住院期间未接受光疗的新生儿出院后随访流程图 [TcB]经皮胆红素;
[TSB]血清或血浆总胆红素。a通过临床判断及综合决策确定4~24 h时间段内何时复查胆红素;
b临床判断应结合体格检查、是否存在高胆红素血症高危因素及高胆红血症神经毒性高危因素、喂养是否充足、体重变化及家庭支持情况而定。
相较于2004版AAP指南及2014版国内共识,2022新版指南强调了对高胆红血症神经毒性高危因素的评估及识别,细化了光疗及换血阈值的胎龄分层,且整体提升了干预阈值。然而,这样的更新对完善新生儿出院后随访制度提出了更高要求。另外,2022版AAP指南与2004版指南一样,最大的弊端是缺乏对胎龄<35周的新生儿提供治疗建议,因此,在早产儿高胆红素血症管理中,仍需参考2014版国内共识。同时,考虑到黄疸存在的人群种族差异性,积极开展基于国内新生儿人群的新生儿黄疸临床研究,并基于这些研究证据更新国内指南,将为我国新生儿科医师管理高胆红素血症提供更有针对性的参考。
猜你喜欢 光疗胎龄胆红素 遗传性非结合性高胆红素血症研究进展中国现代医生(2022年19期)2022-11-04丙种球蛋白联合光疗治疗新生儿ABO溶血病的临床疗效中国典型病例大全(2022年7期)2022-04-22新生儿不同部位经皮胆红素值与血清总胆红素值的对比中国典型病例大全(2022年7期)2022-04-22不同胎龄、不同出生体重新生儿的首次肝功能指标的差异性昆明医科大学学报(2021年3期)2021-07-22早期综合干预对小于胎龄儿生长发育、体格发育和智能发育等影响观察中华养生保健(2020年10期)2021-01-18探讨对新生儿高胆红素血症患儿进行强化光疗的效果世界复合医学(2019年11期)2019-12-20Bhutani曲线在新生儿高胆红素血症治疗中的应用中外医疗(2016年28期)2016-11-09新生儿胆红素和总胆汁酸测定的临床意义中国卫生标准管理(2015年16期)2016-01-20不同胎龄胎鼠脊髓源性神经干细胞特性比较中国康复理论与实践(2015年10期)2015-12-24振幅整合脑电图监测不同胎龄早产儿宫外环境下脑发育的多中心观察性研究中国循证儿科杂志(2015年2期)2015-05-04