急性肾损伤中肾小管上皮紧密连接的研究进展
韦 伟 杨乐天 综述 赵宇亮 审校
急性肾损伤(AKI)表现为可由多种因素导致的有效肾小球滤过率(GFR)的快速降低,是住院患者常见的并发症,显著延长患者住院时间、增加医疗花费,部分患者可进展为慢性肾脏病甚至终末期肾病。重症AKI患者常常合并多种脏器衰竭、死亡率高,是全球范围内一项重大的医疗挑战。AKI的病理生理机制复杂,至今尚未完全阐明。肾小管上皮细胞(TEC)线粒体分布集中、代谢活跃,对伤害刺激敏感,是AKI主要的受累细胞。TEC破坏可加重炎症反应和氧化应激,引起免疫和能量代谢紊乱,进一步加重疾病过程。紧密连接是连接和锚定相邻TEC的主要结构,对于维持肾小管屏障的完整性至关重要。在AKI中,紧密连接结构破坏可能导致肾小管反漏,引起有效GFR的下降和容量复苏抵抗型少尿,TEC的紧密连接结构的破坏是诱发AKI的关键因素。动物研究表明AKI伴随着紧密连接结构破坏和紧密连接相关蛋白表达异常,而修复紧密连接的结构则能有效降低AKI发病率。对紧密连接的深入理解将有助于深入阐释AKI的发病机制,并寻找AKI潜在的新型治疗靶点。本文主要从紧密连接的分布和结构、紧密连接和AKI的关系,紧密连接在AKI诊疗中的应用等方面进行综述。
紧密连接是一种亚细胞器,广泛分布于各种组织或器官的上皮细胞和内皮细胞,在顶端膜和基底外侧膜构成细胞间黏膜的屏障,起“栅栏”和“屏障”作用。紧密连接能够阻止溶质向细胞间隙扩散,调节离子、水和分子的转运,维持内环境稳态。早在上世纪发现,在多种动物的不同器官的细胞之间,如肾脏、肝脏、脾脏、腮腺、肾上腺等,都存在紧密连接,起到扩散屏障或“密封”的作用,是上皮屏障功能的结构基础。
紧密连接主要由跨膜蛋白(claudin家族、occludin家族、tricellulin家族、JAM家族)和闭锁小带蛋白(ZO-1、ZO-2和ZO-3)组成完整的分子屏障(图1)。跨膜蛋白通过羧基端与ZO蛋白家族(ZO-1)的支架蛋白相互作用,经肌动蛋白结合到细胞骨架上,ZO-1作为紧密连接和肌动蛋白细胞骨架之间的连接,共同定位于顶端上皮细胞之间的连接处,形成紧密连接结构[2],共同调节细胞旁间隙的通透性,维持细胞的极性和器官的正常生理功能,如TEC的选择渗透性。细胞旁的渗透性至少由直径为~4Å的电荷选择小通道途径和直径至少为~60Å的分子渗透的选择途径共同决定。
各类组织或器官上皮细胞的紧密连接结构相似,功能相近。如肠上皮细胞中,紧密连接结构与肾小管细胞紧密连接结构相似,由跨膜蛋白和支架蛋白构成,其完整性对于维持细胞间水、离子和大分子的细胞旁通透性具有重要作用,屏障完整性的破坏会激活免疫细胞并导致肠道炎症。Hwang等[3]评估紧密连接蛋白在小鼠中各脏器中的分布,发现occludin、ZO-1和JAMs在肾、肠、肝、肺和大脑均有表达,表达水平无明显差异,共同维持离子和溶质的渗透性。在小鼠的上皮细胞紧密连接链中也有claudin和occludin的表达。针对人肾小管上皮细胞(HK-2)的研究证明claudin-2、occludin和ZO-1在人类TEC表达丰富,使用siRNA下调紧密连接蛋白基因,TEC屏障功能受损和细胞旁通透性改变,证明紧密连接是维持TEC正常生理功能的必要结构。而通过敲除犬肾细胞(MDCK细胞)的tricellulin基因表达,增加了离子的渗透性。显而易见,claudin、occludin、JAMs、tricellulin和ZO蛋白是构成肾小管上皮细胞紧密连接主要结构,且分布在肾脏的不同节段(图2)。
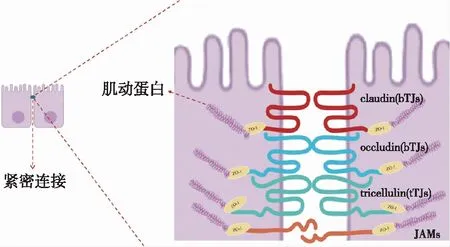
图1 肾小管上皮细胞紧密连接结构示意图bTJs:双细胞紧密连接;tTJs:三细胞紧密连接

图2 肾脏紧密连接蛋白的分布示意图occludin:闭合蛋白;ZO-1:闭锁小带蛋白1;JAML:连接黏附分子样蛋白;JAM4:连接黏附蛋白4
claudin蛋白claudins是一类属于跨膜蛋白家族的紧密连接蛋白,分子质量在21~34 kD,包括4个疏水的跨膜区、2个细胞外环结构、1个细胞内环和位于胞质中的羧基末端、氨基末端,其中第一个细胞外环定位在细胞旁孔,决定了细胞旁通道的选择性,第二个细胞外环则介导反式相互作用。claudin各亚型通过反式和顺式相互作用形成紧密连接链,其羧基端则直接与ZO-1相互作用。
claudin蛋白作为紧密连接最重要的组成部分,决定细胞旁的转运,紧密连接的紧密程度是离子和水的选择性、渗透性的主要决定因素,其紧密程度主要取决于claudin的亚型及其组合方式。1998年,Furuse等[4]首次发现claudin-1和claudin-2,在上皮细胞紧密连接形成对离子和水具有选择性和渗透性的细胞旁通路;在缺乏紧密连接的纤维细胞中,引入外源性claudin-1促进了紧密连接的形成,特异性敲除MDCK细胞的claudin-4后,紧密连接的结构的完整性和复杂性显著降低,均表明claudin蛋白在紧密连接中起核心作用。

occludin蛋白occludin蛋白是第一个被发现的紧密连接蛋白,其分子量约为65 kD,由四个跨膜结构域、两个细胞外环和一个细胞内环构成,有一个较短的N端和一个较长的C端,C端与ZO-1、ZO-2相连,对紧密连接结构的形成与稳定至关重要。紧密连接结构的破坏,伴随着occludin表达的改变,引起上皮细胞屏障的受损,导致一系列疾病。朱茂英等[6]用慢病毒转染抑制occludin蛋白的表达,发现紧密连接结构的紧密程度也跟随下降。在MDCK细胞中occludin和ZO-1蛋白的表达下降,导致了肾小管上皮细胞屏障的破坏。occludin蛋白的表达水平与内皮屏障的特异性呈正相关,但其具体机制有待阐明。
tricellulin蛋白tricellulin紧密连接属于跨膜MAGUK家族,包括两个细胞外环和细胞质内的N端、C端,通细胞连接处的肌动球蛋白促进紧密连接的形成,封闭了上皮细胞的三细胞间连接处的间隙,主要影响大分子物质的通透性,在双细胞紧密连接中主要降低离子的渗透性。它参与了细胞迁移和分裂的方向、调节细胞增殖和细胞动力学特性,使上皮细胞更好的发挥屏障作用[7]。
tricellulin蛋白主要定位于紧密连接。Ikenouchi等[8]研究发现在不同的脏器中,tricellulin蛋白主要表达于上皮细胞的三细胞紧密连接处,当tricellulin蛋白的表达受到抑制时,上皮细胞的紧密连接的结构发生改变,屏障功能受损。以上表明了tricellulin蛋白是组成上皮细胞屏障的一部分。
JAM蛋白JAM蛋白是一类单跨膜蛋白,属于免疫球蛋白超家族,可以选择性的富集于各类上皮细胞的紧密连接处,调节上皮细胞的极性。1998年,Sosnovtsev等[9]首次发现了JAM蛋白。JAM蛋白是由一个细胞外区域的两条Ig样结构域的N端、一个单跨膜蛋白区和一个在胞质尾部具有Ⅱ型PDZ 结构域的C端组成,主要家族成员有JAM-A、JAM-B、JAM-C、JAM-4和JAM-L蛋白。其中JMA4与ZO-1共同存在于肾小球,与膜相关鸟苷酸激酶蛋白MAGUK-1在紧密连接处相互作用,调节肾小球上皮细胞的通透性。JAM蛋白表达的改变与肾脏疾病的发生相关。在Fu等[10]研究首次发现,在糖尿病肾病及其他伴蛋白尿的慢性肾脏病中,肾小球中的JAML表达显著升高,在足细胞损伤的发生发展过程中发挥重要作用。
ZO蛋白ZO蛋白是紧密连接的支架蛋白,属于MAGUK蛋白家族,ZO-1、ZO-2和ZO-3分子质量分别为210~225 kD、160 kD和130 kD,由PDZ结构域(PDZ1、PDZ2和PDZ3)、一个SH3结构域和一个鸟苷酸激酶同源(GUK)的结构域构成。其富集于上皮细胞间的紧密连接,ZO蛋白的PDZ结构域与跨膜蛋白紧密连接蛋白的羧基端结合,与肌动蛋白结合固定于细胞骨架上,作为支撑细胞紧密连接蛋白的平台[11],稳定紧密连接,防止物质的自由扩散,维持自身的极性。在小鼠和犬的各类器官的上皮细胞紧密连接均存在ZO-1、ZO-2;抑制上皮细胞ZO-1、ZO-2的表达,虽然上皮细胞分化良好,但紧密连接完全缺乏。ZO的损伤或缺失,导致紧密连接结构的不完整,降低紧密连接的机械敏感性,破坏细胞旁的通透性。ZO-1在许多相关肾脏疾病的近端小管中表达均为上调,进一步证明了ZO是紧密连接的重要组成部分。
紧密连接损伤是启动AKI的关键因子,其损伤程度与AKI的严重程度密切相关,影响AKI 的预后。许多研究发现,不同类型的AKI均伴随紧密连接结构及其相关蛋白表达的改变。
缺血再灌注急性肾损伤(IR-AKI)在IR-AKI模型中,紧密连接结构被破坏,TEC的紧密连接蛋白的表达水平改变,IR-AKI的发生与紧密连接蛋白密切相关。李志辉等[12]发现,IR-AKI模型小鼠claudin-2、claudin-10、claudin-17 蛋白和mRNA的表达显著下降。通过敲除claudin-2基因,小鼠IR-AKI的易感性增加。对AKI进行干预后,claudin-2表达的上调,细胞和肾功能的损伤减轻。claudin-17蛋白和mRNA的表达上调,24 h后开始下调;对IR-AKI进行缺血预处理后,上述蛋白的改变趋势趋于平缓。claudin-7在肾脏缺血性损伤中表达的升高也被证实。在IR-AKI的研究中,Huang等[13]发现连接黏附分子样蛋白(JAML)的表达上调,抑制其表达则可减轻肾脏炎症,减轻肾缺血再灌损伤;Lee等[14]研究发现occludin和ZO-1蛋白表达的下调,TEC的紧密连接链断裂;Xiong等[15]研究发现ZO-1、claudin-1和claudin-4表达的下调;Meurer等[16]研究发现,claudin(2、10、16、19)表达的下调;Kieran等[17]研究显示claudin(1、3、7)表达上调;而Tet2的缺乏加重了IR-AKI,下调了clauidn-8和ZO-1的mRNA水平。在肾脏移植诱导的IR-AKI中,ZO-1的表达水平下调。在不同类型的IR-AKI中均发现claudin-1和claudin-7表达的下调。
脓毒症急性肾损伤(SAKI)在SAKI中,亦发现了TEC的紧密连接结构的破坏及其蛋白表达水平改变。脂多糖(LPS)诱导AKI的发生后,肾小管的通透性发生改变,紧密连接处发生渗透,细胞内外发生水肿。有相关研究显示,在SAKI中伴随TEC的凋亡和ZO-1表达的下调。在SAKI体、内外模型研究发现, ZO-1、occludin、claudin-5蛋白表达下调,肾小管上皮细胞的紧密连接处的通透性发生改变,加重肾脏损伤;Cheng[18]等发现,occludin蛋白的表达下调,损伤肾脏;Zheng等[19]研究发现TEC中紧密连接的破坏及其JAM-3表达的下调;Eadon等[20]发现,ZO-1、claudin-4的蛋白表达下调,而mRNA表达则上调;claudin-1、claudin-3均表现为上调;claudin-8只有mRNA表达水平下调;证实了SAKI伴随着TEC紧密连接蛋白的变化。
药物相关AKI肾脏是清除体内代谢物质、废物及药物的重要器官,肾毒性药物会损伤肾脏,引起AKI。在赭曲霉毒素A所致AKI中,肾细胞膜通透性增加,紧密连接结构被破坏,occludin和ZO-1蛋白表达下调。在顺铂诱导的AKI小鼠模型中,发现claudin-2、ZO-1的表达均下调,而claudin-5 的表达未发生明显改变;Lee等[21]在顺铂诱导的AKI小鼠模型发现,ZO-1和occludin蛋白表达的下调;Kim等[22]发现,通过阻断JAM-C的表达,减轻了炎症,在一定程度上恢复了肾功能。在顺铂、阿霉素和叶酸诱导的AKI中,均观察到ZO-1的表达减少,且TEC的存活率下降。
其他类型AKI马希刚等[23]在急性肺损伤大鼠的肾损伤模型发现claudin-5、ZO-1蛋白表达的下调,而通过上调claudin-5、ZO-1蛋白后,可减轻急性肺损伤大鼠的肾损伤。在重金属诱导的AKI也伴随紧密连接结构的破坏,影响肾脏功能。在AKI患儿肾组织中,伴有claudin-2的表达逐渐减少,且与肾损伤呈负相关。在小鼠单侧输尿管梗阻(UUO)诱导的AKI中亦有occludin蛋白表达下调。在IgA肾病及UUO-AKI发现claudin-1的表达上调,且依赖于肿瘤坏死因子α(TNF-α)的浓度。clauin-1的表达在造影剂所致的AKI中也表现为上调。在坏死性肠炎引起的AKI中伴有claudin(1~4、8)蛋白水平表达的上调;在疟疾相关性、烧伤脓毒性脑肾综合征诱导的AKI发现ZO-1的表达减少和紧密连接的破坏。Xu等[24]在TNF-α诱导的AKI发现TEC的紧密连接结构被破坏,occludin和ZO-1表达的下调。在新生儿高压氧所致的肾损伤伴随claudin-4、occludin和ZO-1表达的下调。
AKI体外实验在体外细胞实验中,AKI伤害刺激后也观察到细胞紧密连接出现类似变化。如有学者使用过氧化氢一过性刺激MDCK Ⅱ细胞,借以模拟的IR-AKI中的氧化应激反应,实验发现occludin、claudin-1和claudin-2在肾小管的定位发生改变、表达出现下调[25]。在S-AKI的研究中,使用LPS刺激HK-2细胞,肾小管上皮细胞的通透性升高,JAM-3表达显著下降[19]。在使用赭曲霉毒素A刺激后,MDCK细胞的紧密连接受到破坏,occludin和ZO-1的表达和定位发生明显的改变。
AKI伴其他器官损伤AKI常波及远处全身器官紧密连接的破坏。已有相关文献报道AKI可引起肠上皮、肺上皮和血脑屏障等器官或组织的破坏。如在重症AKI患者中,常常合并急性肺损伤,导致病死率增加,经过CRRT治疗后急性肺损伤得到改善[26]。在IR-AKI诱发的肺部炎症反应,伴随着肺上皮细胞的紧密连接的claudin-4、claudin-18和JAM-1表达下调。除了波及肺上皮细胞的紧密连接,IR-AKI还可引起的脑微血管内皮细胞claudin-5和occludin的mRNA水平表达的上调,损伤紧密连接。
作用于紧密连接蛋白的药物,可以调节紧密连接蛋白的表达,减轻肾脏炎症和损伤,改善肾功能。因此,紧密连接可作为AKI新的治疗靶点。AKI干预措施对紧密连接蛋白影响的总结见表1。

表1 AKI干预措施对紧密连接蛋白的影响
在SAKI鼠模型中,使用右美托咪定和盐酸戊乙奎醚进行干预,在一定程度上调了ZO-1和occludin蛋白的表达[27-28];二氢青蒿素的抗炎作用,维持了occludin蛋白的表达[18];全氟化碳促进ZO-1表达上调[29];注射谷氨酰胺后,ZO-1的表达水平发生改变[30];消退素D1(AT-RvD1)预处理可恢复clauidn-4的表达[34]。
在顺铂诱导的AKI中,使用乳酸杆菌干预后,ZO-1和occludin表达上调[21]。脯氨酸羟化酶(FG-4592)的干预可恢复叶酸AKI导致的TEC结构及功能的损伤[35]。在缺血再灌注/叶酸诱导的AKI中,EZH2和3-DZNeP预处理改善了ZO-1的下调[32]。在造影剂诱导的AKI中,使用福辛普利或替米沙坦治疗,改善了claudin-1的下调[33]。在链脲佐菌素诱导的肾损伤中,使用黄酮类化合物治疗,上调了occludin表达水平[31]。使用一氧化氮合酶抑制剂也可保护MDCK细胞免受辐射的损害,修复紧密连接结构。
小结:紧密连接结构的破坏是上皮细胞损伤的标志,紧密连接蛋白的定位和表达水平发生改变,导致TEC的屏障受损,严重影响肾脏的生理功能,加速AKI向慢性肾脏病、终末期肾病的进展;而对紧密连接蛋白进行干预后,AKI得到控制,提示紧密连接蛋白可作为AKI潜在的治疗靶点。尽管目前有许多研究在分析紧密连接结构、生理功能和病理取得重大进展,证实紧密连接结构与AKI的发生密切相关,但紧密连接潜在发病机制尚不清楚。今后有待更多针对不同类型AKI研究进一步揭示紧密连接与AKI的关系,验证紧密连接蛋白作为AKI早期发生、发展的标志物和潜在的治疗靶点的应用前景。
猜你喜欢 膜蛋白通透性肾小管 科学家利用非极性包装获高稳定膜蛋白医药前沿(2019年26期)2019-12-11盆栽与大田栽培水稻的生长及产量的比较研究天津农业科学(2016年3期)2016-03-12依帕司他对早期糖尿病肾病肾小管功能的影响初探中外医疗(2015年11期)2016-01-04猪杀菌/通透性增加蛋白基因siRNA载体构建及干扰效果评价畜牧兽医学报(2015年3期)2015-07-05IgA肾病患者血清胱抑素C对早期肾小管间质损害的预测作用医学研究杂志(2015年8期)2015-06-22细胞因子在慢性肾缺血与肾小管-间质纤维化过程中的作用医学研究杂志(2015年12期)2015-06-10高糖对体外培养人脐静脉内皮细胞通透性及肌球蛋白轻链磷酸化的影响郑州大学学报(医学版)(2015年2期)2015-02-27EB病毒潜伏膜蛋白1基因多态性与NK/T细胞淋巴瘤的相关性癌变·畸变·突变(2015年4期)2015-02-27梅毒螺旋体四种膜蛋白克隆重组表达和ELISA法建立的应用研究现代检验医学杂志(2015年1期)2015-02-06活性维生素D3对TGF-β1诱导人肾小管上皮细胞转分化的作用西南军医(2015年6期)2015-01-23