基于高通量测序分析桃蚜体内微生物群落结构及多样性
徐昭焕,李 婷,廖 嵩,王建国
(江西农业大学农学院,南昌 330045)
昆虫体内栖息着大量的微生物,并形成复杂的群落结构,对昆虫生长发育、代谢繁殖等生命活动发挥着重要作用,如能为宿主昆虫提供食物缺乏且自身无法合成的必需氨基酸(Fragoetal.,2012),参与宿主昆虫的物质代谢(Gaioetal.,2011),影响宿主昆虫的生长发育和繁殖(Mitrakaetal.,2013)、解毒作用(Adamsetal.,2013;Masonetal.,2014)、防御能力(Tsuchidaetal.,2010)及信息素合成(Dillonetal.,2000)等。昆虫体内微生物主要为细菌、古细菌、原生动物、真菌和病毒等(魏舸等,2018),且食物对其多样性具有重要影响(魏晓莹等,2019)。研究发现刺吸式口器昆虫烟粉虱取食相同植物后,其体内微生物组成具有高度相似性,但取食不同植物后,其体内微生物组成存在显著差异(Suetal.,2016)。食物对咀嚼式口器昆虫体内微生物多样性的影响研究主要针对肠道微生物,如以地中海松PinushalepensisMill.为食的松异舟蛾Thaumetopoeapityocampa肠道中变形菌门Proteobacteria细菌的丰度低于以欧洲黑松PinusnigraArn.、落叶松Larixgmelinii(Ruprecht) Kuzeneva或海岸松PinuspinasterAiton为食的松异舟蛾(Stranoetal.,2018);
取食人工饲料和不同寄主植物的小菜蛾Plutellaxylostella幼虫肠道细菌多样性及其群落结构也存在显著差异(吴晓露等,2019)。
桃蚜MyzuspersicaeSulzer,属半翅目Hemiptera蚜科Aphididae,食性广泛,主要取食十字花科植物、茄果类蔬菜、芝麻SesamumindicumL.及桃PrunuspersicaL.、李PrunussalicinaLindl.、烟草NicotianatabacumL.等经济类植物,并传播植物病毒,导致植物营养恶化,影响农作物的产量和品质,造成重大经济损失。刘艳红等(2018)研究发现孤雌桃蚜体内次生共生菌在不同寄主植物间,尤其是冬寄主和夏寄主间的差异很大。目前,对桃蚜体内微生物多样性及群落结构与食物之间的关系以及桃蚜体内微生物对寄主适应性的影响作用研究资料积累较少。鉴于此,本研究采用Illumina HiSeq二代高通量测序方法,分析桃蚜取食不同寄主植物后体内微生物(细菌和真菌)群落的多样性及差异性,以为后续深入研究桃蚜体内微生物与寄主植物间的互作关系提供理论基础和思路借鉴。
1.1 供试昆虫
研究所需供试昆虫为2020年1月采集自江西农业大学科技园白菜和甘蓝上的无翅孤雌桃蚜成虫。
1.2 桃蚜体内微生物总基因组DNA的提取
分别取白菜和甘蓝上的无翅孤雌桃蚜成虫各50头,每组设置3个重复。桃蚜饥饿处理2 h后,用75%酒精对其虫体表面消毒3次,每次3 min,然后用无菌蒸馏水清洗3遍,晾干虫体。用TreliefTMAnimal Genomic DNA Kit试剂盒参照说明书分别提取白菜和甘蓝上的桃蚜体内微生物总基因组DNA。使用微量蛋白核酸测定仪(NanoDrop 2000,美国)测定DNA浓度及OD260/OD280值,并用1%琼脂糖凝胶电泳检测提取的总DNA。
1.3 细菌16S rRNA基因和真菌ITS基因的PCR扩增和高通量测序
使用F引物:5′-ACTCCTACGGGAGGCAGCAG-3′和R引物:5′- GGACTACHVGGGTWTCTAAT-3′扩增细菌V3-V4区域。使用F引物:5′- CTTGGTC ATTTAGAGGAAGTAA-3′和R引物:5′- GCTGCGTT CTTCATCGATGC-3′扩增真菌ITS1区。PCR扩增体系总体积均为50 μL:基因组DNA模板60 ng、Q5 High-Fidelity DNA Polymerase 0.2 μL、10 × Buffer 10 μL、正反向引物各10 μM、dNTPs 1 μL、High GC Enhancer 10 μL。PCR扩增条件:95℃预变性5 min、95℃变性1 min、50℃退火1 min、72℃延伸1 min、25个循环,最后72℃延伸7 min。PCR扩增产物经2%琼脂糖凝胶电泳检测后,利用Illumina HiSeq 2500测序平台进行测序(北京擎科生物科技有限公司)。
1.4 序列数据分析
测序获得的原始序列(Raw reads)经过滤后进行引物序列的识别与去除,获得不包含引物序列的高质量序列。利用overlap对每个样品高质量的序列进行拼接,获得优质序列(Clean reads),鉴定并去除嵌合体序列,得到最终有效数据(Effective reads)。
借助Usearch软件对相似度水平低于97.0%的Reads进行聚类分析,获得分类操作单元(OTU)。以SILVA和UNITE为参考数据库分别对扩增获得的细菌16S rRNA基因和真菌ITS基因序列进行物种注释。利用QIIME 2软件对样品Alpha多样性指数进行评估,包括ACE、Chao1、Simpson及Shannon指数。
2.1 桃蚜微生物基因组测序结果分析
6个桃蚜样品经微生物基因组测序,对其细菌16S rRNA基因序列文库分析共获得480 400对Reads,双端Reads经质控、拼接后共产生473 750条Clean reads,每个样品至少产生78 474条Clean reads,平均产生78 958条Clean reads。在97%相似性水平上进行聚类分析,共获得959个OTUs(图1-A)。结果分析发现取食白菜的桃蚜中细菌OTUs数量平均为898个,其中特有OTUs为 69个;
取食甘蓝的桃蚜中细菌OTUs数量平均为890个,其中特有OTUs为61个。真菌ITS基因序列文库经分析共获得480 263条Reads,双端Reads经质控、拼接后共产生472 980条Clean reads,每个样品至少产生78 575条Clean reads,平均产生78 830条Clean reads,在97%相似性水平上进行聚类分析,共得到1 424个OTUs(图1-B)。取食白菜的桃蚜中真菌OTUs数量平均为1 251个,其中特有OTUs为219个;
取食甘蓝的桃蚜中真菌OTUs数量平均为1 205个,其中特有OTUs为173个。样品稀释曲线显示,随着抽样序列数量的增加,曲线由陡然上升趋向平缓,随后进入平台期(图2),说明更多的测序量不会引起物种多样性的显著增长,基于现有数据量的分析结果是准确可靠的。

图1 取食两种食物的桃蚜体内细菌(A)和真菌(B)OTUs的韦恩分析Fig.1 Venn analysis of OTUs of bacteria (A) and fungi (B) of Myzus persicae fed on two diets注:BoM,取食白菜的桃蚜;
BpM,取食甘蓝的桃蚜,下同。Note:BoM,M.persicae fed on Brassica pekinensis;BpM,M.persicae fed on Brassica oleracea. The same below.

图2 取食两种食物的桃蚜体内细菌(A)和真菌(B)组成稀释曲线Fig.2 Rarefaction curves of the observed species of bacteria (A) and fungi (B) of Myzus persicae fed on two diets
2.2 桃蚜体内微生物种类组成及其丰度分析
基于OTUs分类结果,共注释鉴定细菌类群26个门、55个纲、128个目、227个科、419属、451种,真菌类群10个门、31个纲、77个目、172个科、343属、441种。
在细菌门级水平上,取食白菜的桃蚜16S rRNA基因序列共注释了变形菌门Proteobacteria(占73.11%)、厚壁菌门 Firmicutes(占9.74%)、拟杆菌门Bacteroidetes(占5.98%)、蓝细菌门Cyanobacteria(占2.91%)、酸杆菌门Acidobacteria(占2.18%)、放线菌门Actinobacteria(占2.5%)、绿弯菌门Chloroflexi(占1.34%)、芽单胞菌门Gemmatimonadetes(占0.54)、髌骨细菌门Patescibacteria(占0.32%)、ε-变形菌Epsilonbacteraeota(占0.23%)等(图3-A)。取食甘蓝的桃蚜16S rRNA基因序列共注释了变形菌门Proteobacteria(占80.10%)、蓝细菌门Cyanobacteria(占4.91%)、厚壁菌门Firmicutes(占3.71%)、酸杆菌门Acidobacteria(占3.42%)、放线菌门Actinobacteria(占2.07%)、拟杆菌门Bacteroidetes(占1.71%)、绿弯菌门Chloroflexi(占1.09%)、芽单胞菌门Gemmatimonadetes(占0.50%)、髌骨细菌门Patescibacteria(占0.43%)、ε-变形菌Epsilonbacteraeota(占0.25%)等(图3-A)。取食白菜和甘蓝的桃蚜体内细菌优势门种类相似,但不同种类样品细菌的优势门相对丰度存在差异。两者的优势菌群为变形菌门Proteobacteria、厚壁菌门Firmicutes、拟杆菌门Bacteroidetes和蓝细菌门Cyanobacteria等。其中取食白菜和甘蓝的桃蚜体内变形菌门Proteobacteria含量均最为丰富,分别占73.11%和80.10%;
其次为厚壁菌门Firmicutes,分别占9.74%和3.71%;
拟杆菌门Bacteroidetes,分别占5.98%和1.71%。由此分析发现,取食白菜的桃蚜中变形菌门Proteobacteria含量高于取食甘蓝的桃蚜,而厚壁菌门Firmicutes和拟杆菌门Bacteroidetes,前者含量则明显高于后者,说明二者具明显差异性。
在真菌门级水平上,取食白菜的桃蚜ITS基因序列共注释了子囊菌门Ascomycota(占51.91%)、担子菌门Basidiomycota(占10.89%)、被孢霉门Mortierellomycota(占2.22%)、毛霉菌门Mucoromycota(占1.79%)、罗兹菌门Rozellomycota(占1.68%)、壶菌门Chytridiomycota(占1.60%)、油壶菌门Olpidiomycota(占0.33%)、球囊菌门Glomeromycota(占0.06%)、捕虫霉门Zoopagomycota(占0.05%)等(图3-B)。取食甘蓝的桃蚜ITS基因序列共注释了子囊菌门Ascomycota(占50.98%)、担子菌门Basidiomycota(占11.40%)、被孢霉门Mortierellomycota(占2.24%)、毛霉菌门Mucoromycota(占1.78%)、罗兹菌门Rozellomycota(占1.64%)、壶菌门Chytridiomycota(占1.68%)、油壶菌门Olpidiomycota(占0.30%)、球囊菌门Glomeromycota(占0.07%)、捕虫霉门Zoopagomycota(占0.01%)等(图3-B)。取食白菜和甘蓝的桃蚜体内真菌优势门种类相似,两者的优势菌群均为子囊菌门Ascomycota,次优势菌群为担子菌门Basidiomycota。
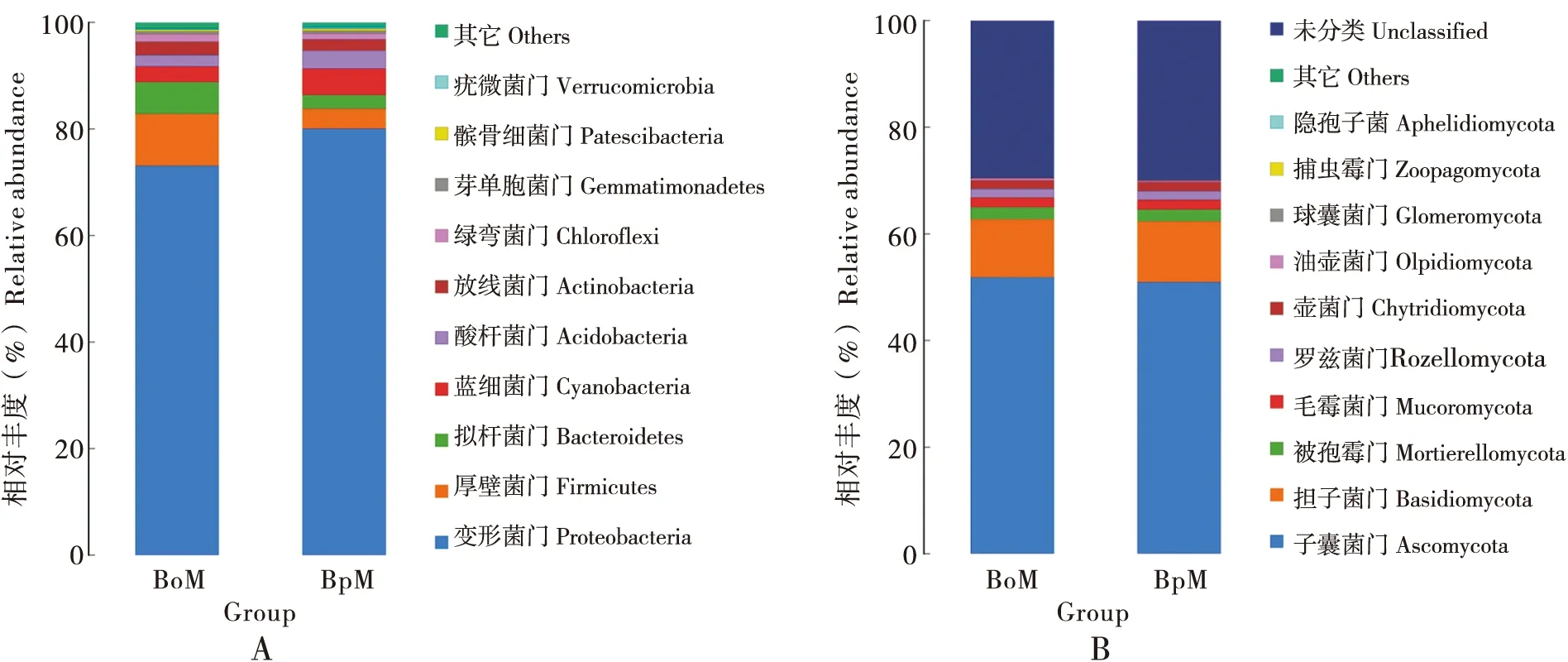
图3 桃蚜体内细菌(A)和真菌(B)在门水平的组成Fig.3 Proportional composition of bacteria (A) and fungi (B) of Myzus persicae at the phylum level
在细菌属级水平上,取食白菜的桃蚜16S rRNA基因序列注释到的平均相对丰度前十位的细菌属分别为布赫纳氏菌属Buchnera(占60.82%)、未培养的叶绿体菌Chloroplast(占2.84%)、拟杆菌属Bacteroides(占2.18)、不动杆菌属Acinetobacter(占1.79%)、乳杆菌属Lactobacillus(占1.28%)、未培养的毛螺旋菌Lachnospiraceae(占1.13%)、未培养细菌c.6亚群Subgroup_6(占0.77%)、立克次氏小体属Rickettsiella(占0.45%)、鞘氨醇单胞菌属Sphingomonas(占0.45%)和泛菌属Pantoea(占0.43%)(图4-A)。在属级分类水平上,取食甘蓝的桃蚜16S rRNA基因序列注释到的相对丰度前十位的细菌属分别为布赫纳氏菌属Buchnera(占56.11%)、立克次氏小体属Rickettsiella(占10.04%)、未培养的毛螺旋菌Lachnospiraceae(占6.96%)、叶绿体菌Chloroplast(占4.88%)、泛菌属Pantoea(占2.51%)、鞘氨醇单胞菌属Sphingomonas(占1.68%)、未培养细菌c.6亚群Subgroup_6(占1.47%)、不动杆菌属Acinetobacter(占1.43%)、乳杆菌属Lactobacillus(占0.42%)和拟杆菌属Bacteroides(占0.34%)(图4A)。取食白菜和甘蓝的桃蚜体内细菌优势属种类相似,但不同种类样品细菌的优势属相对丰度存在一定差异。取食白菜和甘蓝的桃蚜体内的布赫纳氏菌属Buchnera均最为丰富,分别占73.11%和80.10%;
而取食白菜的桃蚜中立克次氏小体属Rickettsiella含量比取食甘蓝的桃蚜低9.59%,两者具有明显差异性。

图4 桃蚜体内细菌(A)和真菌(B)在属水平的组成Fig.4 Proportional composition of bacteria (A) and fungi (B) of Myzus persicae at the genus level
在真菌属级水平上,大量真菌属未能确定,优势真菌属不明显。取食白菜的桃蚜ITS基因序列注释到的平均相对丰度前十位的真菌属分别为青霉属Penicillium(占5.15%)、被孢霉属Mortierella(占3.83%)、镰孢菌属Fusarium(占3.51%)、曲霉属Aspergillus(占3.46%)、三角菌属Triangularia(占2.69%)、沙蜥属Saitozyma(占2.68%)、毛葡孢属Botryotrichum(占2.50%)、木霉属Trichoderma(占1.57%)、篮状菌属Talaromyces(占1.94%)和枝孢属Cladosporium(占0.90%)(图4B)。取食甘蓝的桃蚜ITS基因序列注释到的相对丰度前十位的真菌属分别为被孢霉属Mortierella(占3.86%)、曲霉属Aspergillus(占3.93%)、镰孢菌属Fusarium(占3.59%)、三角菌属Triangularia(占2.96%)、毛葡孢属Botryotrichum(占2.82%)、沙蜥属Saitozyma(占2.60%)、枝孢属Cladosporium(占2.35%)、木霉属Trichoderma(占1.50%)、青霉属Penicillium(占1.23%)和篮状菌属Talaromyces(占1.04%)(图4B)。取食白菜的桃蚜体内真菌优势属为青霉属Penicillium(占5.15%),次优势菌属为Mortierella(占3.83%);
取食甘蓝的桃蚜体内真菌优势属为曲霉属Aspergillus(占3.93%),次优势菌属为Mortierella(占3.86%);
取食白菜的桃蚜中青霉属Penicillium的丰度比取食甘蓝的桃蚜低3.92%,两者具有明显差异性。
2.3 桃蚜细菌Alpha多样性分析
桃蚜细菌种类具有较高的丰富度和多样性。取食白菜的桃蚜体内细菌Shannon、Simpson、Chao1和Ace等的指数分别为3.99、0.61、744和731(表1)。取食甘蓝的桃蚜体内细菌Shannon、Simpson、Chao1和Ace等的指数分别为3.70、0.59、764和729(表1)。二者对应指数比较发现,桃蚜体内细菌的Shannon、Simpson、Chao1和Ace等指数虽略有波动,但无显著性差异,说明取食白菜和甘蓝的桃蚜体内细菌多样性和丰富度无显著变化,其体内菌群多样性和丰富度呈现相对稳定的状态。

表1 桃蚜体内微生物α多样性指数Table 1 Alpha diversity indices of microbia of Myzus persicae
桃蚜真菌种类具有较高的丰富度和多样性。取食白菜的桃蚜体内真菌Shannon、Simpson、Chao1和Ace等的指数分别为7.65、0.98、854.04和839.16(表1)。取食甘蓝的桃蚜体内真菌Shannon、Simpson、Chao1和Ace等的指数分别为7.66、0.06、830.42和803.12(表1)。Shannon、Ace和Chao1指数越大,Simpson指数越小,表明样品中的物种多样性越丰富。因此,取食甘蓝的桃蚜体内真菌物种多样性明显高于取食白菜的桃蚜。
昆虫体内栖息着大量的共生菌,这些共生菌在长期进化过程中与昆虫形成了稳定密切的协作共生关系,对昆虫适应寄主植物过程具重要作用。共生菌除能合成宿主所需的氨基酸、维生素和其它营养物质以弥补宿主取食中相关营养缺失的不足,还能对宿主所摄取的植物次生物质进行解毒作用,提高其对寄主植物的利用能力,甚至扩大寄主植物范围(刘艳红,2016)。为探明桃蚜体内微生物与食物之间的关系,本研究采用Illumina HiSeq二代测序技术检测桃蚜体内细菌16S rRNA基因和真菌ITS基因序列的方法,分析了取食白菜和甘蓝的桃蚜体内细菌和真菌的多样性和丰富度。基于OTUs注释结果分析,桃蚜体内细菌型微生物注释鉴定获得26个门、55个纲、128个目、227个科、419属、451种;
真菌型微生物注释鉴定获得10个门、31个纲、77个目、172个科、343属、441种。
对桃蚜体内细菌和真菌组成和丰度进行比较分析发现,在门级水平上,鉴定的26个细菌门中,以变形菌门Proteobacteria(73.11%)内细菌含量最多。该门内细菌在一些常见昆虫体内也为主要优势菌,如豌豆蚜Acyrthosiphonpisum(Haynesetal.,2003)、美国白蛾Hyphantriacunea(魏丹峰等,2017)、灰飞虱Laodelphaxstriatellus(杨晓晴等,2018)和褐飞虱Nilaparvatalugens(王天召等,2019)等昆虫。目前,针对昆虫体内真菌多样性的研究相对滞后(蔡泱莲等,2020)。本研究鉴定的桃蚜体内10个真菌门中,以子囊菌门Ascomycota为主,其次为担子菌门Basidiomycota,此结果与光肩星天牛Anoplophoraglabripennis(Masonetal.,2019)、褐飞虱(王天召等,2019)、克里角梢小蠹Trypophloeusklimeschi(高冠群,2018)、黄翅大白蚁Macrotermesbarneyi(孙新新,2017)、竹虫Omphisafuscidentalis(刘松,2017)、桑天牛Aprionagermari和锈色粒肩天牛Aprionaswainsoni(蔡泱莲等,2020)等昆虫肠道真菌优势菌群相同。
在属级水平上,鉴定的桃蚜体内419个细菌属中,以布赫纳氏菌属Buchnera最为丰富,在取食白菜和甘蓝的桃蚜体内分别占73.11%和80.10%。此属为蚜虫的主要初生共生菌,存在于蚜虫类腹部血腔的特化含菌胞内(Douglas,1998)。布赫纳氏菌属Buchnera对蚜虫而言是必需的,能够为宿主蚜虫提供所缺少的多种必需营养物质,对于维持蚜虫营养代谢和正常发育具重要的作用(刘琳等,2013)。立克次氏小体属Rickettsiella为取食甘蓝的桃蚜体内次优势属(10.04%),而取食白菜的桃蚜中立克次氏小体属Rickettsiella的含量较低,仅占0.45%。立克次氏小体属Rickettsiella是蚜虫的次共生菌,能改变蚜虫体色,提高蚜虫对寄生蜂的敏感性及对瓢虫和病原性真菌的抗性(Tsuchidaetal.,2010;ukasiketal.,2013),但目前对该属细菌是否参与桃蚜的营养代谢等方面还需进一步研究。本研究发现桃蚜体内大量真菌未能注释鉴定到属,已鉴定的343个真菌属中,优势属不明显,且有的属在取食不同食物的桃蚜体内含量存在差异,如取食白菜的桃蚜中青霉属Penicillium的丰度比取食甘蓝的桃蚜低3.92%,可能与青霉属Penicillium具有产生抑菌活性物质的能力有关(王天召,2019)。
此外,对桃蚜体内细菌和真菌的多样性和丰富度比较显示,取食白菜的桃蚜中细菌OTU数量与取食甘蓝的桃蚜基本相等(分别为898个和890个),这些OTU中有829个是相同的。将这些OTUs均一化处理后进行Alpha多样性分析发现,取食白菜和甘蓝的桃蚜体内细菌Shannon、Simpson、Chao1和Ace等对应指数虽略有波动,但无显著性差异,说明二者桃蚜体内细菌多样性和丰富度无显著变化,桃蚜体内的菌群多样性和丰富度呈现相对稳定的状态。取食白菜的桃蚜体内真菌Simpson指数高于取食甘蓝的桃蚜,说明取食甘蓝的桃蚜体内真菌物种多样性明显高于取食白菜的桃蚜,可能是因为食物的营养成分不同所致。
研究发现昆虫体内微生物多样性与食物﹑性别﹑品种及环境因素有关(Suetal.,2016)。不同寄主植物会引起昆虫肠道微环境的变化(Leeetal.,2017),进而导致肠道微生物多样性的差异。本研究发现取食白菜和甘蓝的桃蚜体内微生物菌群存在差异,但差异不显著。桃蚜营转寄主生活,存在冬寄主(桃、梨Pyrusspp.、李等)和夏寄主(甘蓝、白菜、萝卜RaphanussativusL.、油菜BrassicachinensisL.、茄子SolanummelongenaL.、烟草、菠菜SpinaciaoleraceaL.等)。研究选用的白菜和甘蓝均属于夏寄主,桃蚜可能在夏寄主间迁飞,进行稳定的孤雌生殖,使种群趋于一致,导致桃蚜体内微生物差异不显著。此结果与刘艳红等(2018)对桃蚜共生菌研究结果一致,其研究发现冬寄主和夏寄主上孤雌桃蚜体内共生菌差异较大,但不同夏寄主间桃蚜体内次生共生菌相似。本研究初步分析了两种十字花科蔬菜对桃蚜体内微生物群落结构的影响,为进一步探明桃蚜体内微生物的功能及其与寄主植物的关系,后续研究将增加寄主植物种类并借助宏基因组技术,探究肠道微生物在桃蚜消化吸收中的功能和作用,以期为深入研究桃蚜食性及其对不同寄主植物的适应性提供有力依据。
猜你喜欢 菌门甘蓝白菜 特殊竹林土壤细菌群落结构及多样性研究科学技术与工程(2022年26期)2022-11-01一棵白菜趣味(作文与阅读)(2022年3期)2022-06-10不同强化处理措施对铜污染土壤微生物多样性的影响中国农学通报(2022年14期)2022-06-01白菜长黑点还能吃吗?今日农业(2022年4期)2022-06-01基于自主核酸提取方法分析单油井采出液微生物*油气田环境保护(2022年2期)2022-05-09开水白菜小读者(2021年6期)2021-11-23羊与白菜小猕猴智力画刊(2021年9期)2021-10-11刚竹属3个竹种根际土壤微生物群落结构世界竹藤通讯(2020年5期)2020-11-11变色的紫甘蓝动漫界·幼教365(中班)(2020年8期)2020-06-29厨房色彩游戏幼儿教育·父母孩子版(2018年8期)2018-12-28