右美托咪定减轻红藻氨酸引起的神经毒性作用
孟明华 马宾 赵坤 王纪明 任伟华
(1济南市第二妇幼保健院,山东 济南 271199;
济南市人民医院 2麻醉科;
3药剂科)
癫痫是最常见的大脑疾病之一,全世界约有5 000万人受其影响〔1,2〕。虽然癫痫发作的确切原因尚不清楚,但大量证据表明,过度释放谷氨酸参与了癫痫发作的发病机制。如脑内应用谷氨酸受体激动剂已被证明可诱发动物癫痫。右美托咪定具有镇静,镇痛麻醉作用。右美托咪定的神经保护作用已在各种脑损伤模型中被报道〔3〕。然而,右美托咪定的神经保护作用机制尚未完全清楚。红藻氨酸(KA)是一种类似于兴奋毒性谷氨酸的物质,它在啮齿动物体内的全身性给药会导致反复发作和随后大脑中选择性神经元群的退化,特别是在海马的CA3区域。因此,KA常被用于研究兴奋性毒性诱导的神经变性机制,以提出具有潜在神经保护作用的药理学药物〔4〕。本研究以KA诱导的癫痫模型为基础,探讨右美托咪定对神经的保护作用及机制。
1.1材料 动物:成年雄性SD大鼠,体重200~220 g,所有大鼠饲养房间温度为(23±2)℃,湿度为50%~60%,并保持12 h的昼夜循环光照。药品与试剂:右美托咪定(批号:026M4732V,美国Sigma公司);
KA(美国Abcam公司);
Tunnel染色试剂盒(中国碧云天公司);
尼氏染色试剂盒(中国索莱宝公司);
兔多克隆抗体Caspase-3、Caspase-9、Caspase-12(美国Abcam公司)。仪器:FM0530化学发光成像系统(美国 Protein Simple公司);
DM 750 光学显微镜(日本Olympus公司);
Thermo VarioskanTMLUX多功能酶标仪(美国的Thermo Fisher Scientific公司)。
1.2构建KA诱导神经元凋亡的模型及给药 大鼠随机分对照组、KA组、K+D组各15只。对照组:大鼠腹腔注射0.9% NaCl;
KA组:大鼠腹腔注射KA(15 mg/kg)构建模型;
K+D组:在注射KA前30 min腹腔注射右美托咪定(5 μg/kg),1次/d,给药3 d。
1.3癫痫发作评分 实验动物在注射KA后4 h内进行监测,以确定癫痫发作的严重程度。根据Racine量表对大鼠KA模型进行癫痫评分。该量表评分为0~5分,0分为正常现象,1分为面部和耳部抽搐,2分为单侧前肢抽搐,3分为双侧前肢完全抽搐,4分为强制性阵挛发作,5分为广泛的强制性阵挛发作。模型鼠出现4级及以上评分的视为达到癫痫模型的标准。
1.4尼氏染色 实验动物在第3天后用1%戊巴比妥钠麻醉,待麻醉成功后,逐层皮肤解剖大鼠暴露心脏后,先用0.9%生理盐水灌注,再用4%多聚甲醛灌注,灌注成功后,断头解剖海马组织,放于多聚甲醛固定48 h。组织经过冲洗,梯度酒精脱水,二甲苯透明,浸透制作石蜡切片。选出完整的海马组织切片,按尼氏染色试剂盒进行染色,然后脱水、透明,封片,在显微镜下观察并拍照。
1.5TUNEL染色 为了观察凋亡细胞,根据TUNNEL染色试剂盒对海马组织切片进行染色。用新鲜配制的透性处理液(含0.1% Triton X-100的0.1%柠檬酸钠的缓冲液)处理海马组织切片,然后在冷磷酸盐缓冲液(PBS)中洗涤,在37℃的潮湿环境中与TUNEL反应液避光孵育60 min,用PBS洗涤3次,加入封闭液于室温封闭30 min,PBS洗涤,加入转化剂37℃孵育10 min,洗涤,加入二氨基联苯胺(DAB)底物,室温15 min,苏木素复染50 s,进行酒精脱水,二甲苯透明,封片,最后使用荧光显微镜观察神经元细胞凋亡情况。
1.6Western印迹 将各组大鼠断头处死,解剖出脑组织,在冰上立即分离海马组织,通过研磨匀浆提取总蛋白,测定蛋白浓度〔二喹啉甲酸(BCA)定量〕。然后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),先清洗玻璃板,灌胶和上样,然后电泳至溴酚蓝跑出即可终止电泳,按照滤纸-胶-膜-滤纸夹三明治的方法进行转膜,若胶上的条带均转移到膜上即成功,进行封闭,将膜取出在5%脱脂奶粉的皿中常温慢摇60 min,然后Caspase-3一抗1∶1 000,Caspase-9一抗1∶1 000,Caspase-12一抗1∶1 000在4℃冰箱孵育过夜,用TBST清洗3次,然后二抗在室温下孵育1~2 h,用TBST在摇床上清洗两次,每次10 min,再用TBST洗10 min,最后用BIO-RAD公司凝胶成像系统显色成像进行定量分析,分析蛋白表达情况。
1.7统计学方法 采用SPSS21.0软件行方差分析。
2.1大鼠癫痫发作评分结果 在给予KA后30 min内,动物均表现出持续3~4 h的癫痫行为。与对照组〔(0.00±0.00)分〕比较,KA组癫痫发作评分〔(4.51±0.42)分〕明显升高;
与KA组相比,K+D组评分〔(2.44±0.51)分〕降低(P<0.05)。
2.2尼氏染色观察大鼠海马神经元 与对照组相比,KA组海马CA3区神经元数目显著减少,细胞排列疏松。K+D组海马CA3区神经元数目较KA组增多,且细胞排列较密集,有显著改善作用,见图1。
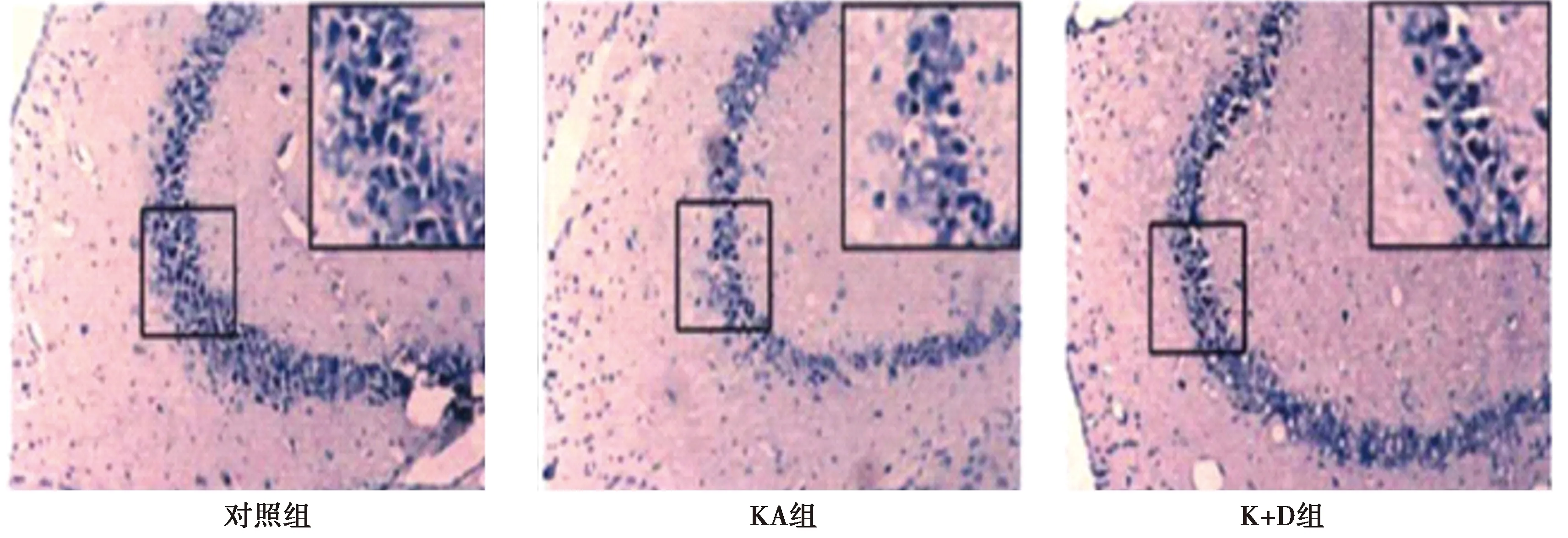
图1 尼氏染色观察各组海马神经元的病理学形态(×200,框中×400)
2.3TUNEL染色测定神经元细胞凋亡 对照组存在少量凋亡细胞;
与对照组相比,KA组显著增加了海马CA3区神经元凋亡数目;
与KA组比较,K+D组海马组织CA3区神经元凋亡数目显著减少,因此右美托咪定具有抑制由KA引起的细胞凋亡的作用,见图2。
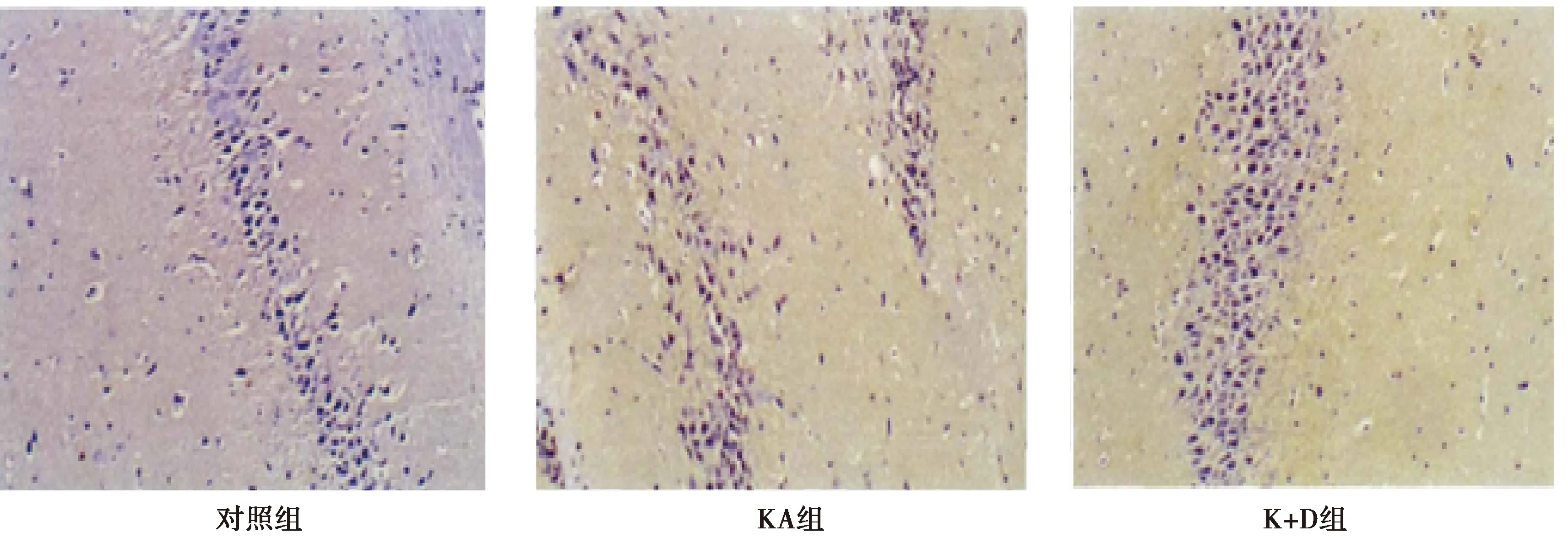
图2 Tunnel染色观察各组海马神经元凋亡情况(×200)
2.4各组海马组织Caspase-3、Caspase-9、Caspase-12的蛋白表达 与对照组相比,KA组海马神经元Caspase-3、Caspase-9、Caspase-12蛋白表达显著升高,而K+D组海马神经元Caspase-3、Caspase-9、Caspase-12表达较KA组明显降低(P<0.05),见表1,图3。

表1 各组海马组织Caspase-3、Caspase-9、Caspase-12蛋白表达比较

图3 Western印迹检测海马组织Caspase-3、Caspase-9、Caspase-12蛋白表达
众所周知,在阿尔茨海默病、帕金森病、癫痫、亨廷顿病等神经退行性疾病中,兴奋性应激是急性神经元损伤的促进因素〔5,6〕。以前的报告已经证明,在啮齿动物中使用类似于谷氨酸兴奋毒素的KA会导致癫痫发作〔7〕。本研究表明右美托咪定对KA引起的癫痫发作有体内抗惊厥作用。海马体的CA3区是kainate受体最丰富的区域,它们的激活导致海马体和其他大脑结构中选择性种群的神经元缺失。此外,大量研究表明,在这种兴奋毒性模型中观察到的神经元损失至少部分涉及凋亡〔8,9〕。本研究结果表明,KA注射可导致海马CA3区选择性神经元细胞凋亡。右美托咪定预处理减少了这种诱导的神经元凋亡,提示右美托咪定除了是一种抗惊厥剂外,还是一种有效的神经保护剂。
研究表明,内质网应激介导的细胞凋亡通路可诱导兴奋性毒性模型的凋亡〔10〕。内质网是细胞内钙储存的场所之一,兴奋性毒性诱导的钙在内质网应激通路中起重要作用,导致细胞凋亡〔11〕。凋亡信号传导包括3个阶段:信号诱导、Caspase级联激活和执行阶段。其中Caspase-3、Caspase-9和Caspase-12在细胞凋亡中具有重要作用,Caspase-3是多种Caspase亚型中的主要Caspase,它能导致神经元细胞的死亡,是凋亡细胞死亡过程中主要的Caspase执行者,其特异性地裂解许多关键的细胞蛋白,促进细胞的解体〔12〕,Caspase-9是凋亡小体内固有凋亡的关键启动子,在多种细胞死亡诱导因子的作用下被激活,Caspase-12特异性定位于内质网的胞质部位(外膜),被认为在应激介导的细胞死亡〔13〕中发挥作用。细胞凋亡的内在途径包括线粒体外膜的通透化、死亡诱导信号复合物的形成、DNA片段化和Caspase-3的激活。本研究结果表明,KA诱导的Caspase-3、Caspase-9和Caspase-12激活的减少与右美托咪定发挥神经保护作用的机制有关。
综上,右美托咪定对KA构建的癫痫模型大鼠海马凋亡具有显著的神经保护作用,而这种神经保护作用可能是由于通过抑制神经元凋亡起作用,减轻了由KA引起的神经毒性作用。而对于具体抑制凋亡的机制还尚不清楚,未来应进一步研究。
猜你喜欢 咪定海马美托 右美托咪定在腰硬联合麻醉下前列腺剜除术高龄患者中的应用中国典型病例大全(2022年11期)2022-05-13海马作文周刊·小学二年级版(2022年20期)2022-05-05小剂量右美托咪定复合瑞芬太尼对全麻拔管期呛咳的影响中国典型病例大全(2022年7期)2022-04-22冠心病心律不齐应用胺碘酮联合美托洛尔治疗效果观察中国药学药品知识仓库(2022年2期)2022-03-23丙泊酚复合右美托咪定或咪达唑仑在老年人无痛胃肠镜检中的应用昆明医科大学学报(2021年2期)2021-03-29右美托咪定抑制大鼠创伤性脑损伤后神经细胞凋亡昆明医科大学学报(2021年2期)2021-03-29萌萌哒之长满痘痘的豆丁海马科技知识动漫(2016年6期)2016-06-24最佳操控奖 海马3运动版汽车观察(2009年1期)2009-02-18