棉花GaLMI1-like基因功能及其启动子表达分析
杨小贝,陈二永,李成伟
(1.河南科技学院 生命科技学院,河南省粮食作物基因组编辑工程技术研究中心,河南 新乡 453003;
2.河南工业大学 生物工程学院,河南 郑州 450001)
叶片是农作物的重要器官,在光合产物的积累、气体交换、养分分配和水分运输中起着重要的作用[1]。叶片形状会显著影响植物的冠层蒸发散热、日光和化学农药的渗透、害虫的喜好以及作物的最终产量和质量[2]。叶形的多样性反映了自然选择对叶片功能的筛选作用,不同叶形是了解其生态学、进化驱动力及其功能意义的宝贵资源[3]。通过改变作物叶形而创制出农艺性状优良的作物新品种是农作物育种需要关注的一个重要方向[4]。
棉花是世界上重要的纤维作物和油料作物,棉纤维大量应用于纺织工业。我国作为棉花生产大国,棉花及其纺织产品在我国国民经济中占有较大比例。棉花是喜光作物,在光照充足的条件下长势较好,光照也是影响棉花植株生长发育和纤维品质优劣的重要条件之一[5]。叶片作为重要的光合器官,叶片形态在棉花品种之间存在显著的表型差异,自然界的棉花拥有如锯齿形、浅裂形、鸡脚形、枫叶形等不同叶形。棉花叶形是影响其冠层结构、产量、耐逆性和其他生产相关属性的重要农艺性状[6]。
现有研究发现,一些基因在叶形发育中起着关键作用。SlLAX1可以平衡叶片近轴和远轴细胞的生长,其突变可引起叶片卷曲表型[7]。ELI-A调控大麦叶舌的发育,ELI-A突变会引起叶鞘边缘发育异常,产生无叶舌的叶片[8]。在拟南芥中过表达BRH1基因可改变叶型,降低叶片的长宽比[9]。AfLFY在烟草中过表达可以调控叶片发育,使其由圆形转变为椭圆形[10]。除了基因可调控叶片发育外,miRNA对叶片发育也有显著影响,如miRNA160单突变体拟南芥在14 d时叶片为锯齿状,同样大小的miRNA165/166突变体叶片为圆形[11]。KNOX1(Class IKNOTTED1-LIKEHOMEOBOX)调控着茎顶端分生组织 (SAM)的形成和维持。KNOX1功能的维持通过其在单叶植物和复叶植物的SAM及叶原基的表达模式差异实现[12]。另一个KNOX1基因SHOOTMERISTEMLESS对叶开裂的形成是十分必要的,在拟南芥中缺失该基因会形成不开裂叶片[13]。杯状子叶基因CUC1、CUC2和CUC3参与胚胎顶端分生组织的形成和子叶边界的特化[14]。CUC2对锯齿状叶的发育起始是必要的,而CUC3参与叶片锯齿状的维持[15]。进一步研究发现,在拟南芥中MIR164A与CUC2协同调控叶缘的锯齿状表型[16]。LMI1(LATEMERISTEMIDENTITY1)基因是拟南芥中形成简单锯齿状叶片所必需的基因,而LMI1基因的缺失导致了苞片的形成[17]。在十字花科中有3种LMI1-like基因,它们的过表达可以改变拟南芥的叶形和产生深裂叶片[18]。BnA10.LMI1正向调控甘蓝型油菜裂片叶的发育[19]。在棉花中,利用基因定位获得一个LMI1同源基因,该基因同样编码一个HD-Zip转录因子,被命名为GhLMI1-D1b,其是棉花叶片形状变化的主要决定因素,将该基因沉默后可诱导叶片从鸡脚叶向浅裂叶的转变[20]。LMI1基因在种子植物中是保守的[21],其在叶形发育中的功能研究非常值得被关注,这些研究为培育理想叶形的农作物新品种提供了坚实的理论基础。
LMI1基因是控制叶形发育的关键基因,但是其同源基因是否均具有调节叶形的功能,以及该基因及其同源基因如何被调控而造成自然界叶形多样性的,目前依然知之甚少。植物形态多样性通常是由发育基因的顺式调节差异和相应的时空表达来调控的[22-23]。顺式调节的差异主要展现在启动子的差异上,因此,研究LMI1同源基因的功能及分析LMI1同源基因的启动子活性对理解LMI1同源基因调控植物叶形的机理具有十分重要的意义。
本研究以具有鸡脚叶表型的亚洲棉石溪亚1号为试验材料,通过特异性引物克隆获得GaLMI1-like基因序列和其启动子序列,构建GaLMI1-like基因过表达载体p6MYC-GaLMI1-like并通过农杆菌介导的蘸花法转化模式植物拟南芥,以验证GaLMI1-like是否具有调控叶形发育的功能。同时,对GaLMI1-like基因启动子序列进行顺式作用元件分析,构建GaLMI1-like启动子GUS表达载体pCAMBIA1391-pGaLMI1-like并转化模式植物拟南芥,经GUS染色分析GaLMI1-like启动子驱动基因表达的模式,为理解GaLMI1-like基因及其启动子在调控棉花叶形方面的功能机制和培育理想株型的棉花提供理论基础。
1.1 试验材料
1.1.1 植物材料 供试材料亚洲棉(Gossypiumarboretum)石溪亚1号、拟南芥 (Arabidopsisthaliana)哥伦比亚型 (Columbia-0,Col-0)均由河南科技学院生命科技学院河南省粮食作物基因组编辑工程技术研究中心保存。
1.1.2 菌株与载体 大肠杆菌(Escherichiacoli)DH5α和农杆菌(Agrobacteriumtumefaciens)GV3101菌株购自上海唯地生物技术有限公司;
克隆载体质粒pMDTM19-T Vector购自宝生物工程(大连)有限公司;
过表达载体质粒p6MYC与启动子GUS表达载体质粒pCAMBIA1391均为河南省粮食作物基因组编辑工程技术研究中心保存。
1.1.3 酶和化学试剂 限制性内切酶 QuickCutTMKpnⅠ、QuickCutTMSpeⅠ、QuickCutTMHind Ⅲ和QuickCutTMBamH Ⅰ、高保真酶PrimeSTAR®GXL DNA Polymerase均购自宝生物工程(大连)有限公司;
BM2000、BM2000+与BM5000+DNA Marker购自北京博迈德基因技术有限公司;
DNA凝胶回收试剂盒及质粒小量抽提试剂盒均购自天根生化科技(北京)有限公司;
GUS染色试剂盒购自北京华越洋生物科技有限公司;
引物由武汉金开瑞生物工程有限公司合成。其余化学试剂均为国产分析纯。
1.2 试验方法
1.2.1 棉花和拟南芥DNA的提取 取亚洲棉石溪亚1号三叶期叶片或者移栽后20 d左右的Col-0拟南芥叶片,放置于研钵中并经液氮冷冻后用研磨棒磨成粉末,依据说明书使用新型快速植物基因组DNA提取试剂盒(百泰克生物技术有限公司,DP3112)进行DNA提取,用于后续GaLMI1-like基因启动子(简称pGaLMI1-like)的扩增或转基因拟南芥阳性植株的鉴定。
1.2.2 棉花和拟南芥RNA的提取及cDNA的合成 取亚洲棉石溪亚1号三叶期叶片或生长21 d的Col-0与GaLMI1-like转基因拟南芥叶片,液氮冷冻后研磨成粉末,使用RNAprep Pure 多糖多酚植物总RNA 提取试剂盒(天根生化科技(北京)有限公司,DP441)提取上述组织的总RNA。RNA提取完成后立即使用PrimeScript®RT Reagent Kit with gDNA Eraser(Perfect Real Time)(TaKaRa,RR047A)合成cDNA,用于GaLMI1-like基因的克隆或者检测GaLMI1-like转基因拟南芥是否为阳性植株。
1.2.3GaLMI1-like基因及GaLMI1-like启动子的扩增 以拟南芥LMI1蛋白序列为参考,在棉花基因组网站COTTONGEN(https://www.cottongen.org/)中利用BlastP同源搜索其在亚洲棉中的同源基因,将与LMI1相似性最大的基因命名为GaLMI1-like。分别以在棉花基因组中检索到的GaLMI1-like基因及GaLMI1-like启动子序列为参考,利用 Primer Premier 6 软件设计以下引物。GaLMI1-like基因过表达扩增引物为GaLMI1-like-F:5′-GGTACCTATGGATTGGAATGGCACCATT-3′,下划线为酶切位点KpnⅠ;
GaLMI1-like-R:5′-ACTAGTTTAGGGATAAGAAGGGAGTTG-3′,下划线为酶切位点SpeⅠ。GaLMI1-like启动子扩增引物序列为pGaLMI1-like-F:5′-AAGCTTACACTCTGCAATCTGCATGAA-3′,下划线表示酶切位点Hind Ⅲ;
pGaLMI1-like-R:5′-GGATCCTTTTCTTTGAATAAAGAAAGCGA-3′,下划线表示酶切位点BamH Ⅰ。以从石溪亚1号棉花提取RNA后反转录获得的cDNA为模板PCR扩增GaLMI1-like基因,同时,以棉花石溪亚1号DNA为模板PCR扩增GaLMI1-like启动子序列。扩增反应体系(20 μL体系):PrimeSTAR®GXL DNA Polymerase 0.2 μL;
5×PrimeSTAR GXL Buffer 4 μL;
cDNA/DNA 1 μL;
GaLMI1-like-F/pGaLMI1-like-F(10 μmol/L)0.5 μL;
GaLMI1-like-R/pGaLMI1-like-R(10 μmol/L)0.5 μL;
2.5 mmol/L dNTPs 2 μL;
ddH2O 11.8 μL。PCR反应程序:98 ℃预变性5 min;
98 ℃变性30 s,56 ℃ 退火30 s,72 ℃延伸45 s,30个循环;
72 ℃继续延伸10 min,4 ℃保存。PCR反应结束后将上述2种PCR反应产物加入新制的1.5%琼脂糖凝胶中。使用电压120 V、电流150 A进行琼脂糖凝胶电泳,运行时长15 min;
然后置于琼脂糖凝胶成像仪中进行观测,PCR产物经琼脂糖凝胶电泳检测正确的条带进行切胶处理,用琼脂糖凝胶回收试剂盒回收纯化目的片段,得到的目的片段进行加A反应后连接到测序载体pMDTM19-T上,构建pMDTM19-T-GaLMI1-like和pMDTM19-T-pGaLMI1-like,分别转化大肠杆菌感受态DH5α并涂布含有氨苄青霉素(50 μg/mL)的LB平板,待长出菌斑后挑取单克隆菌落进行PCR验证,经琼脂糖凝胶电泳检测含有正确目的条带的单菌落进行摇菌培养,之后将菌液送至武汉金开瑞公司进行测序。
1.2.4GaLMI1-like过表达载体及GaLMI1-like启动子GUS表达载体的构建 使用QuickCutTMKpnⅠ和QuickCutTMSpeⅠ酶切pMDTM19-T-GaLMI1-like重组载体,利用QuickCutTMHind Ⅲ和QuickCutTMBamH Ⅰ酶切pMDTM19-T-pGaLMI1-like重组载体,琼脂糖凝胶分离并分别回收GaLMI1-like基因和GaLMI1-like启动子片段。将GaLMI1-like基因与经QuickCutTMKpnⅠ和QuickCutTMSpeⅠ酶切线性化的p6MYC进行连接反应,GaLMI1-like启动子片段与经QuickCutTMHind Ⅲ和QuickCutTMBamH Ⅰ线性化的pCAMBIA1391载体进行连接重组,之后分别转化到大肠杆菌感受态细胞DH5α,然后进行菌落PCR鉴定,经琼脂糖凝胶电泳检测正确的阳性菌落进行摇菌提取质粒,再次用限制性内切酶QuickCutTMKpnⅠ和QuickCutTMSpeⅠ、QuickCutTMHind Ⅲ和QuickCutTMBamH Ⅰ分别酶切鉴定重组载体p6MYC-GaLMI1-like和pCAMBIA1391-pGaLMI1-like,琼脂糖凝胶电泳检测出现大小正确的GaLMI1-like基因和GaLMI1-like启动子片段后可确认成功得到GaLMI1-like过表达载体p6MYC-GaLMI1-like与GaLMI1-like启动子GUS载体pCAMBIA1391-pGaLMI1-like。
1.2.5GaLMI1-like启动子序列分析 运用数据库New PLACE(https://www.dna.affrc.go.jp/PLACE/?action=newplace)和PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对GaLMI1-like启动子序列中包含的顺式作用元件进行分析。
1.2.6 拟南芥转化及转基因拟南芥的鉴定 p6MYC-GaLMI1-like和pCAMBIA1391-pGaLMI1-like转基因拟南芥T0植株的获得采用农杆菌介导的蘸花法[24]。收取转基因拟南芥T0种子,经表面灭菌消毒后均匀地播种在含有潮霉素和头孢霉素的MS筛选培养基上,大约12 d后将筛选获得的根系较长且长出2片真叶的T1幼苗移栽至营养土中,置于光照培养箱中培养。为了验证p6MYC-GaLMI1-like是否成功转化拟南芥Col-0,提取生长21 d的转基因拟南芥叶片RNA并转录成cDNA,利用半定量PCR法检测GaLMI1-like基因在转基因拟南芥中有无上调表达。半定量PCR使用的内参基因为AtUBQ10(At4g05320),引物序列为AtUBQ10-F:5′-CAGAACTTTGGCCGACTAC-3′,AtUBQ10-R:5′-ATGGTCTTTCCGGTGAGAG-3′。同时,为了检测是否获得pCAMBIA1391-pGaLMI1-like转基因拟南芥阳性植株,待转基因拟南芥植株在培养箱中生长30 d后,取叶片提取DNA,PCR鉴定转基因阳性植株。PCR鉴定所使用的引物同载体构建引物,即pGaLMI1-like-F与pGaLMI1-like-R。对PCR鉴定阳性的T1植株进行收种,之后将T1种子点播到含有潮霉素的MS培养基进行抗性筛选以获得T2幼苗,培养方式同T1,直至收获T2种子。拟南芥培养条件设置为光周期16 h光照/8 h黑暗、温度22 ℃(光照)/19 ℃(黑暗)、光照强度12 000 lx、湿度55%[25]。
1.2.7 GUS染色分析 取pCAMBIA1391-pGaLMI1-like转基因拟南芥种子、刚萌发的种子、萌发3 d和12 d的幼苗、生长30 d的茎生叶、花和角果等组织,依照说明书使用华越洋公司的GUS染色剂进行组织化学染色。脱色后的组织材料使用体视显微镜 (AXIO Zoom.V16,Zeiss)进行观察并拍照记录。
2.1 GaLMI1-like蛋白结构域及进化分析
以拟南芥LMI1蛋白序列为参考,利用BlastP在棉花数据库COTTONGEN(https://www.cottongen.org/)中同源搜索其在亚洲棉中的同源基因,将与LMI1同源性最大的同源基因(Cotton_A_00507_BGI-A2_v1.0)命名为GaLMI1-like。利用SMART网站预测GaLMI1-like蛋白的结构域,发现其含有一个homeobox(HOX)结构域(图1-A)。含有HOX结构域的蛋白质多为DNA结合因子,这类蛋白质主要参与关键发育过程的转录调节,这预示着GaLMI1-like蛋白在棉花生长发育中发挥重要作用。利用GaLMI1-like蛋白序列在NCBI(https://www.ncbi.nlm.nih.gov/)中搜索其同源基因,获得其在棉花和其他物种的12种同源基因,进一步利用MEGA 6软件分析GaLMI1-like蛋白与其同源蛋白的进化关系(图1-B),结果表明,GaLMI1-like与同物种陆地棉(Gossypiumhirsutum)中登录号为KAG4215939.1的蛋白质聚在一起,暗示陆地棉中登录号为KAG4215939.1的蛋白质基因起源于亚洲棉的GaLMI1-like基因。同时结果显示,GaLMI1-like蛋白与异源物种木槿中登录号为XP 039051516.1的蛋白质进化关系较近,说明GaLMI1-like蛋白与登录号为XP 039051516.1的蛋白质具有相似的功能。

A.GaLMI1-like蛋白结构域分析;
B.GaLMI1-like及其同源蛋白进化树分析。A.The domain analysis of GaLMI1-like;
B.Phylogenetic tree analysis of GaLMI1-like and its homologous proteins.
2.2GaLMI1-like基因的克隆
以从棉花基因组数据库COTTONGEN(https://www.cottongen.org/)中获取的GaLMI1-like基因序列为参考,设计可扩增其编码区的特异性引物,以从亚洲棉石溪亚1号提取RNA转录获得的cDNA为模板,PCR扩增GaLMI1-like基因,琼脂糖凝胶电泳显示,在681 bp左右有一条明亮条带,与已知GaLMI1-like基因序列大小一致(图2)。对琼脂糖凝胶电泳显示的明亮条带进行胶回收,与pMDTM19-T载体连接获得pMDTM19-T-GaLMI1-like重组载体,测序后与GaLMI1-like基因序列进行比对,结果显示,其与GaLMI1-like基因序列一致,说明成功克隆了GaLMI1-like基因。
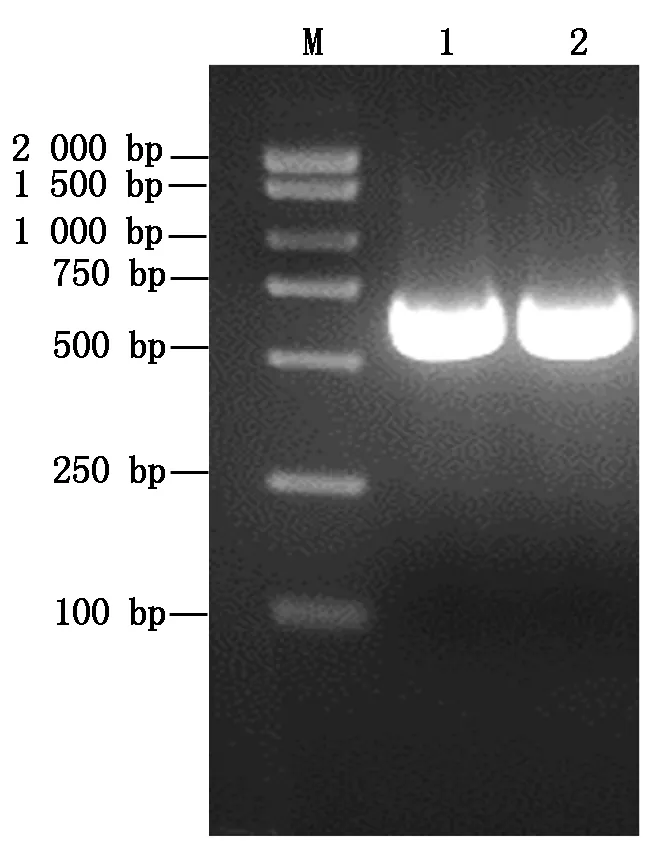
M.DNA Marker;
1,2.GaLMI1-like基因片段。M.DNA Marker;
1,2.GaLMI1-like gene fragment.
2.3 p6MYC-GaLMI1-like载体的构建
为了研究GaLMI1-like基因的功能,设计构建GaLMI1-like的过表达载体。摇菌、提取质粒后利用QuickCutTMKpnⅠ和QuickCutTMSpeⅠ对p6MYC-GaLMI1-like重组载体进行酶切鉴定,结果显示,重组载体被切割为一条680 bp左右的条带和一条大于5 000 bp的条带(图3),与预期的GaLMI1-like基因条带和p6MYC载体条带大小一致,说明已成功构建GaLMI1-like基因的过表达载体p6MYC-GaLMI1-like,重组载体的结构如图4所示。通过冻融法将p6MYC-GaLMI1-like载体转入农杆菌感受态GV3101,挑取单克隆进行菌落PCR 鉴定,选取鉴定正确的阳性菌株进行摇培,甘油保种放置于-80 ℃冰箱,以备转化野生型拟南芥Col-0使用。

M.DNA Marker;
1—3.p6MYC-GaLMI1-like表达载体。M.DNA Marker;
1—3.p6MYC-GaLMI1-like expression vector.

图4 植物表达载体p6MYC-GaLMI1-like的构建示意图Fig.4 The construction diagram of plant expression vector p6MYC-GaLMI1-like
2.4GaLMI1-like基因功能分析
为了验证GaLMI1-like基因在植物生长发育中的功能,利用YEP液体摇培转化有p6MYC-GaLMI1-like重组载体的农杆菌GV3101,采用蘸花法转化盛花期的拟南芥Col-0,收取转基因T0种子,干燥7 d后将其播种于含有潮霉素和头孢霉素的MS培养基上,筛选获得T1幼苗,12 d后将其移栽于营养土中并置于光照培养箱中生长。为了验证所筛选幼苗为阳性植株,提取21 d的拟南芥RNA并反转录为cDNA,半定量PCR法检测GaLMI1-like基因在拟南芥中的表达情况,结果如图5-A所示。在转基因株系和野生型Col-0植株中内参基因(AtUBQ10)表达量相对一致的情况下,野生型Col-0植株中并未检测到GaLMI1-like基因的表达条带,而3个转基因植株均能检测到GaLMI1-like基因的表达条带,说明GaLMI1-like基因已经在拟南芥中成功过表达。待生长30 d后,对3个GaLMI1-like转基因拟南芥阳性植株进行表型观察,发现转基因拟南芥叶片出现多种不同的表型。如图5-B所示,转基因拟南芥叶片表现出单一凹陷缺刻表型和不对称发育表型;
图5-C显示,转基因拟南芥显现出弱的对称缺刻表型;
而图5-D中转基因拟南芥显现出强的对称缺刻表型。这些结果说明,GaLMI1-like在叶片发育尤其是叶片的缺刻表型形成中具有重要作用。

A.半定量鉴定GaLMI1-like转基因拟南芥阳性植株;
B—D.GaLMI1-like转基因拟南芥阳性植株表型观察。A.Identification of GaLMI1-like transgenic Arabidopsis by semi-quantitative PCR;
B—D.The phenotypic analysis of GaLMI1-like transgenic Arabidopsis.
2.5GaLMI1-like启动子片段的克隆
用已知的GaLMI1-like基因序列检索棉花基因组,获取该基因起始密码子(ATG)上游1 439 bp的序列,设计该序列特异性引物,以亚洲棉石溪亚1号基因组DNA为模板进行PCR扩增。PCR产物进行琼脂糖凝胶电泳,结果显示,在1 500 bp左右出现一条清晰明亮的条带,大小与预期一致(图6)。对PCR扩增产物进行胶回收,连接到pMDTM19-T载体获得重组质粒pMDTM19-T-pGaLMI1-like,之后进行测序和序列比对,结果显示,扩增获得的DNA序列与从棉花基因组检索得到的序列完全一致,表明已经成功克隆出GaLMI1-like的启动子序列。
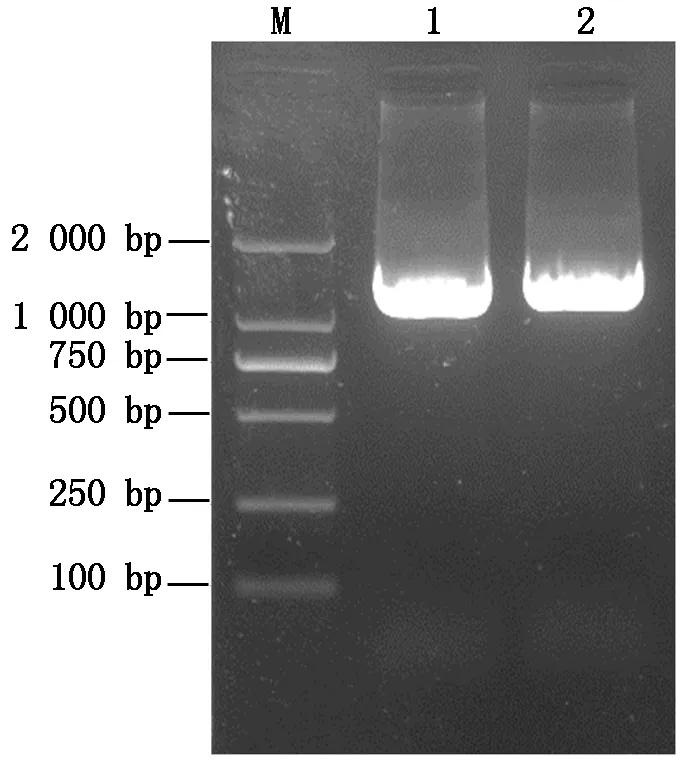
M.DNA Marker;
1,2.GaLMI1-like启动子片段。M.DNA Marker;
1,2.GaLMI1-like promoter fragment.
2.6GaLMI1-like启动子顺式作用元件分析
通过启动子在线分析工具New PLACE和PlantCARE对GaLMI1-like启动子序列所包含的顺式作用元件进行分析,结果发现(表1),该启动子除包含基本启动子元件CAAT-box和TATA-box[26]外,还包含光调节和光响应元件INRNTPSADB、 G-Box、GT1-motif、部分光响应模块Box 4[27]、MYB结合位点参与光响应元件MRE、昼夜节律控制元件Circadian、细胞周期调节元件MSA-like、细胞分裂素响应元件ARR1AT以及叶肉特异表达相关原件CACTFTPPCA1、茎特异表达相关元件NODCON和根特异表达相关元件ROOTMOTIFTAPOX1。这些结果说明,该启动子可能调控下游基因GaLMI1-like对光和昼夜节律的响应,调控其参与细胞周期和对细胞分裂素的响应,以及调控其在叶肉细胞、茎和根细胞中的特异表达。

表1 棉花GaLMI1-like启动子顺式作用元件分析Tab.1 Analysis of cis-acting elements of GaLMI1-like promoter in cotton
2.7 pCAMBIA1391-pGaLMI1-like载体的构建
经菌落PCR鉴定后,摇菌提取质粒进一步利用QuickCutTMBamH Ⅰ和QuickCutTMHind Ⅲ对pCAMBIA1391-pGaLMI1-like重组载体进行酶切鉴定,结果显示,重组载体能够切割出2个片段(图7),一条1 439 bp的条带为pGaLMI1-like片段,另一条较大的条带为pCAMBIA1391载体片段,与预期结果一致,说明GaLMI1-like的启动子GUS载体pCAMBIA1391-pGaLMI1-like已被成功构建,重组载体结构如图8所示。通过冻融法将pCAMBIA1391-pGaLMI1-like载体转入农杆菌感受态GV3101,挑取单克隆进行菌落PCR 鉴定,选取鉴定正确的阳性菌株进行摇培,甘油保种放置于-80 ℃冰箱,以备转化野生型拟南芥Col-0使用。
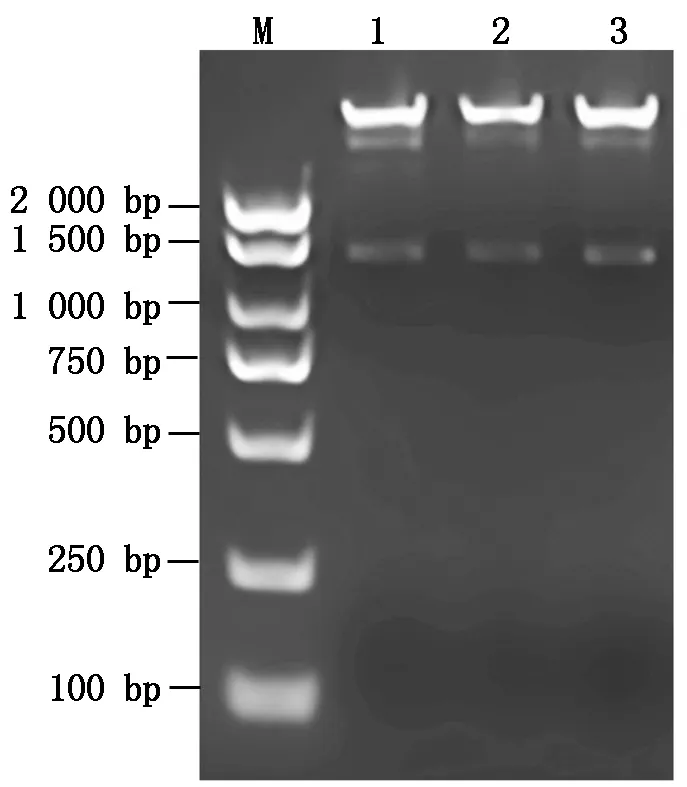
M.DNA Marker;
1—3.pCAMBIA1391-pGaLMI1-like表达载体。M.DNA Marker;
1—3.pCAMBIA1391-pGaLMI1-like expression vector.

图8 植物表达载体pCAMBIA1391-pGaLMI1-like的构建示意图Fig.8 The construction diagram of plant expression vector pCAMBIA1391-pGaLMI1-like
2.8 pCAMBIA1391-pGaLMI1-like转基因拟南芥的鉴定
为了获得利用GaLMI1-like启动子驱动GUS的过表达拟南芥植株,利用蘸花法将pCAMBIA1391-pGaLMI1-like转化盛花期的野生型拟南芥Col-0,成熟后收取T0种子。用含有潮霉素和头孢霉素的MS培养基对T0种子进行筛选,对筛选获得的根系较长且长出真叶的T1幼苗进行移栽培养,30 d后取T1幼苗的叶片进行DNA提取并进行PCR检测,结果如图9所示,转基因阳性植株均能扩增出1 439 bp大小的条带,而野生型对照Col-0未扩增出该目标条带。将T1阳性植株继续培养并收获T1种子;
利用含有潮霉素的MS培养基对T1种子继续筛选,获得T2幼苗并培养收获T2种子,为后续GUS染色分析提供试验材料。
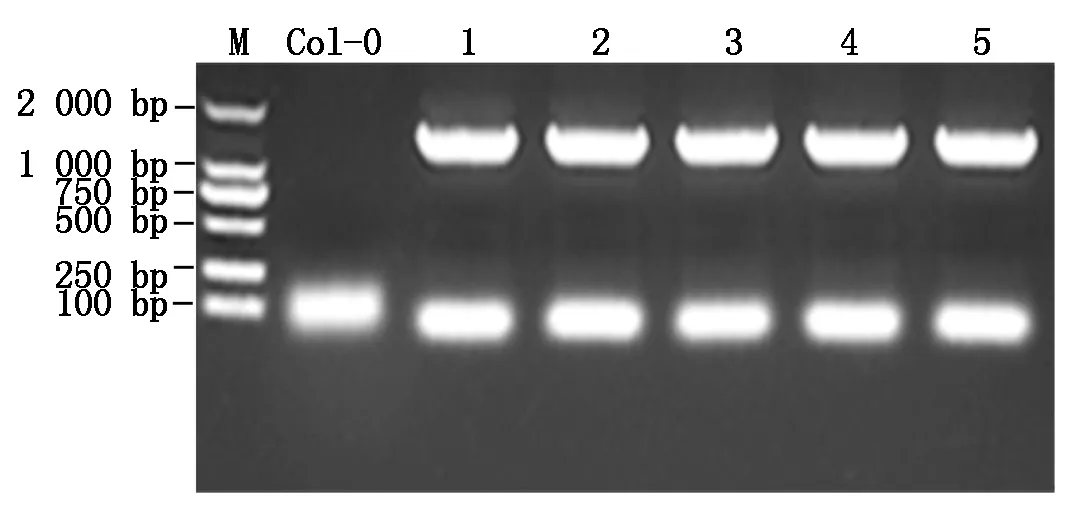
M.DNA Marker;
Col-0.野生型拟南芥(阴性对照);
1—5.转基因拟南芥。M.DNA Marker;
Col-0.Wild Arabidopsis (Negative control);
1—5.Transgenic Arabidopsis.
2.9GaLMI1-like启动子功能分析
为了分析GaLMI1-like基因的启动子功能,对pCAMBIA1391-pGaLMI1-like转基因阳性拟南芥T2种子、刚萌发的种子、3 d的幼苗、12 d的幼苗、茎生叶、花和角果等器官采用GUS染色剂进行组织化学染色,结果显示,GUS主要在子叶、真叶(莲座叶)、茎生叶、茎和根的中柱中表达,而在花、角果和成熟种子中未见表达(图10)。这说明GaLMI1-like基因的启动子可驱动下游基因在子叶、真叶、茎生叶、茎和根的中柱中表达,其中主要在叶片中表达。

A.种子;
B.刚萌发的种子;
C.3 d的幼苗;
D.12 d的幼苗;
E、F.茎生叶;
G.花;
H.角果。A.Seed;
B.Budding seed;
C.Three days old seedling;
D.Twelve days old seedling;
E,F.Stem leaf;
G.Flower;
H.Silique.
在植物界,叶片的类型具有广泛的多态性,这引起了科研人员的浓厚兴趣和对其背后调控机制的广泛研究。在分子水平上,已发现诸多基因参与叶片的生长发育[12-14,16-17],其中LMI1及其同源基因在叶形中的功能不容忽视[17-20]。在棉花中,通过定位发现,GhLMI1-D1b主要调控陆地棉中鸡脚叶的形成,而陆地棉作为四倍体植物(2n=4x=52,AADD)是由二倍体A基因组棉花(2n=2x=26,AA)和二倍体D基因组棉花(2n=2x=26,DD)进化而来的[28-29]。为解析陆地棉中来自D基因组的GhLMI1-D1b控制鸡脚叶形成的原因,及陆地棉中A基因组上的GhLMI1-A能否调控鸡脚叶的发育,用拟南芥LMI1序列同源比对亚洲棉基因组,将与其相似性最大的基因命名为GaLMI1-like,之后进行功能分析。GaLMI1-like蛋白结构域分析发现,其含有homeobox(HOX)结构域,这与对GhLMI1-D1b蛋白结构域的分析结果是一致的。进化分析发现,GaLMI1-like与陆地棉中登录号为KAG4215939.1的蛋白质聚集在一起,而与D基因组棉花雷蒙德氏棉(Gossypiumraimondii)中登录号为XP012469169.1的蛋白质并未完全聚集在一起。说明陆地棉中登录号为KAG4215939.1的蛋白质起源于A基因组亚洲棉的GaLMI1-like,同时A基因组的GaLMI1-like与D基因组的同源蛋白(登录号为XP012469169.1)在功能上应该具有差异性。本试验为了研究GaLMI1-like是否具有调控叶形发育的功能,以具有鸡脚叶表型的A基因组棉花亚洲棉石溪亚1号为材料,克隆了GaLMI1-like基因,并构建了GaLMI1-like基因的过表达载体p6MYC-GaLMI1-like,通过蘸花法转化拟南芥,然后通过筛选获得阳性植株,表型观察发现,与对照Col-0相比,GaLMI1-like转基因过表达拟南芥叶片具有不对称发育表型、凹陷单一缺刻表型和对称缺刻表型,这些结果说明,A基因组棉花中的GaLMI1-like基因可以调控棉花叶片发育及缺刻表型的产生。但是,在四倍体陆地棉中鸡脚叶表型主要是由D基因组的GhLMI1-D1b调控[20],这有可能是A基因组起源的GaLMI1-like基因被抑制了表达,其中的机制还需进一步研究。
研究发现,BnA10.LMI1上游启动子调控区域的变异造成其表达量的上升,进而引起甘蓝型油菜浅裂叶片的形成[19]。RCO(REDUCEDCOMPLEXITY)也是一个LMI1的同源基因,其增强子序列的改变引起了RCO基因表达的差异,从而调控植物产生不同的叶形[21]。在棉花中,GhLMI1-D1b启动子中增加的一个串联重复序列引起该基因表达量的上调,这也是形成鸡脚叶表型的重要原因[20]。综上所述,启动子及其他调控序列所调控的基因表达差异是控制叶形的关键因素。因此,本研究以亚洲棉石溪亚1号为材料,克隆了棉花中LMI1同源基因GaLMI1-like的启动子序列,通过分析发现,该启动子序列具有多个TATA-box和CAAT-box等启动子核心元件,说明其具有典型启动子的特征。GaLMI1-like启动子序列除具有典型的启动子核心元件外,还包含许多与基因功能相关的调节元件,其中有光响应元件G-Box、GT1-motif、INRNTPSADB,昼夜节律调控元件Circadian,茎特异表达元件NODCON,根特异表达元件ROOTMOTIFTAPOX1,部分光响应模块Box 4[27],MYB结合位点参与光响应元件MRE。LMI1及其同源基因的主要功能是调控叶片发育形成不同叶形[17-20],本研究也在GaLMI1-like启动子序列中发现许多发育调节相关元件,如细胞周期调节元件MSA-like、细胞分裂素响应元件ARR1AT、叶肉特异表达元件CACTFTPPCA1,这些结果暗示,GaLMI1-like启动子调控GaLMI1-like的时空表达进而调控棉花的叶形。进一步将GaLMI1-like启动子连接到GUS报告基因载体pCAMBIA1391获得重组表达载体pCAMBIA1391-pGaLMI1-like,转化拟南芥并筛选获得T2材料。组织化学染色结果显示,GaLMI1-like启动子主要驱动GUS报告基因在子叶、真叶(莲座叶)、茎生叶、茎和根的中柱中表达,而在花、角果和成熟种子中未见表达。这些结果与对GaLMI1-like启动子基因功能相关的调节元件分析结果是一致的。在组织化学染色结果中发现,子叶、真叶(莲座叶)和茎生叶中GUS染色较深,其他能够染色的部位较浅,这与之前报道LMI1及其同源基因主要控制叶形发育的研究结果[17-20]是一致的。LMI1主要在叶片的边缘表达,尤其是在锯齿状部位表达量较高[17];
LMI1的同源基因RCO主要在碎米芥的2个小叶之间的凹陷处表达[21],这与本研究发现的GaLMI1-like启动子驱动GUS基因几乎在整片叶子中表达不同。说明同源基因在表达模式上存在种属差异性,所以需要对具体物种中LMI1基因的调控机制进行有针对性的研究。
综上所述,利用PCR技术克隆了A基因组棉花亚洲棉石溪亚1号的GaLMI1-like基因及其启动子序列,分析了GaLMI1-like蛋白的结构域和进化关系,并构建了GaLMI1-like基因的过表达载体p6MYC-GaLMI1-like,通过转化拟南芥证实了GaLMI1-like基因具有调控叶片缺刻表型发育的功能。同时,通过在线软件分析了该基因启动子的顺式作用元件,构建了GaLMI1-like启动子与GUS报告基因融合的植物表达载体并转化了模式植物拟南芥,通过GUS染色分析了GaLMI1-like基因的组织表达模式,结果显示,GaLMI1-like启动子可驱动下游基因在根、茎、叶中表达,且主要在叶中表达。本研究结果为进一步揭示GaLMI1-like调控棉花叶形发育的机理和利用GaLMI1-like培育理想叶型的棉花新品系奠定了基础。
猜你喜欢 拟南芥同源转基因 药食同源 药膳产品成就养生新风潮今日农业(2022年1期)2022-11-16山西恩予:打造药食同源新业态今日农业(2022年2期)2022-11-16未来航天员的“神菜”——转基因莴苣军事文摘(2022年12期)2022-11-03转基因,你吃了吗?今日农业(2022年3期)2022-06-05同源宾语的三大类型与七项注意新高考·英语进阶(高二高三)(2018年8期)2018-01-15拟南芥飞碟探索(2015年9期)2015-11-05口水暴露了身份红领巾·探索(2015年9期)2015-09-10一株特立独行的草恋爱婚姻家庭·养生版(2011年8期)2011-05-14玩转转基因少年科学(2009年11期)2009-07-09同源字典青年文摘·上半月(1983年8期)1983-01-01