不同浓度全氟辛烷磺酸对拟南芥叶片的代谢损伤机制
张越,刘潇威,张艳伟*,张景然,刘冰洁
(1.农业农村部环境保护科研监测所,天津 300191;
2.上海SCIEX分析仪器贸易有限公司,上海 200335)
全氟辛烷磺酸(Perfluorooctane sulfonate,PFOS)作为一种持久性有机污染物,因其具有良好的稳定性、疏水性和疏油性而被广泛应用于工业生产和日常生活中。PFOS不易降解,可随环境多介质迁移,并通过食物链在生物组织和人体内蓄积。尽管PFOS已于2009年被列入《关于持久性有机污染物的斯德哥尔摩公约》并被禁止使用,但由于监管力度不够和政策滞后,PFOS的污染依然普遍存在。到目前为止,PFOS在全球各地的环境、动物和人体内已均被检出,实验证明PFOS具有免疫毒性、生殖毒性、神经毒性等多种毒性,然而大部分研究集中在动物体内,PFOS对植物体的生态毒性研究较少。
迄今为止,国内外已开展了部分有关PFOS植物体毒性的研究。多数研究集中在形态学的表型变化、生理生化指标的失调和氧化应激反应酶的活性变化等,而对植物体是否存在除氧化应激效应之外的毒性依然不清,并且不同浓度造成植物体毒性效应的差异还尚不清晰。目前已有研究发现,在代谢水平上低浓度PFOS能够对生菜营养品质造成影响,还能够破坏关键的能量代谢途径。植物中三羧酸循环、乙醛酸和二羧酸代谢及丙酮酸代谢可以被PFOS和全氟辛酸(Perfluoro octanoic acid,PFOA)显著影响,PFOS还能干扰亚油酸的代谢。低浓度PFOS可以改变生菜根系中酪氨酸代谢、嘌呤代谢、异喹啉生物碱生物合成和萜类主链生物合成。PFOS的暴露对植物中矿物质的含量也存在一定影响,除Zn之外,Na、Mg、Cu、Fe、Ca、Mo含量降低1.8%~47.8%。此外,PFOS还可以影响植物的基因表达,参与酰胺和肽的生物合成,以及肽、细胞酰胺、糖代谢的基因表达上调和细胞壁合成、碳固定、光合作用的基因表达下调。然而不同浓度对植物代谢损伤存在差异的研究却比较匮乏。利用代谢组学研究不同浓度PFOS对植物体代谢水平上的毒性效应可以获得更全面的毒性效应信息,有助于完善我国对PFOS的生产和使用法案等政策的制定。
为探究PFOS在植物体代谢水平上的毒性效应,降低植物体种间差异带来的不同毒性效应,本实验拟选取具有代表性的模式生物拟南芥为研究对象;
为了更全面地反映PFOS对植物体的多角度、多层面的毒性效应,选取高通量非靶向代谢组学技术探究上千种内源代谢物的变化表征对植物的毒性效应;
为了避免微生物和环境因素对实验结果产生影响,采用室内控制无菌实验来获得可靠的单一因素实验结果;
为探究不同浓度水平的毒性效应差异,选取了5种不同暴露水平。针对暴露于5种PFOS浓度30 d后的拟南芥叶片样品,分析其内源代谢物的变化,利用统计学分析方法,探究其代谢毒性效应及机制,以为PFOS的生态毒性和风险评估提供理论依据。
1.1 仪器、试剂与材料
仪器:高效液相色谱四极杆飞行时间串联质谱仪(TripleTOF6600,美国SCIEX公司),涡旋混合器(美国赛默飞公司),高速冷冻离心机(H1850,中国湘仪公司),真空冷冻干燥机(Alpha 1-4,德国Christ公司),超纯水机(美国密理博公司),氮吹仪(FV-64,中国得泰仪器公司),多管漩涡振荡器(LPD2500,中国莱普特公司),多功能破碎仪(Yube Mill CS025,德国IKA公司),立式压力蒸汽灭菌锅(YXQ-LS,中国博讯公司),智能人工气候箱(RTOP-1000D,中国钱江公司)。
试剂与材料:甲醇、乙腈和异丙醇购于美国Fisher Chemical公司,甲基叔丁基醚购于美国Avantor公司,甲酸购于中国阿拉丁公司,甲酸铵购于中国Macklin公司,氨水购于比利时Acros Organics公司,1/2MS培养基(Cat#M8525)购于北京索莱宝公司,PFOS标准物质购于德国Alorich公司,拟南芥种子(哥伦比亚野生型)购于北京华越生物。
1.2 拟南芥的无菌栽培暴露实验
近年来对工业园区附近的地表水检测结果显示,全氟化合物的最高检出浓度可达1 mg·L以上。2016年LIU等对我国山东东猪龙河和小清河流域附近地表水进行检测,发现全氟烷酸含量高达1.86 mg·L;
2018年WANG等对该附近区域地表水监测发现PFOA含量最高可达1.14 mg·L。而在对美国河流沉积物的检测中发现,特斯拉河与拉斯维加斯水湾处的沉积物中全氟化合物含量分别可达0.272 9 mg·kg和0.345 7 mg·kg。因此本研究选择0.1 mg·L和1 mg·L作为低浓度暴露组研究PFOS对拟南芥的代谢损伤机制。目前关于PFOS生态毒性的研究主要集中在低水平暴露,而高、低浓度PFOS对植物的毒性作用存在较大差异。LI等发现低浓度PFOS可以促进凤眼莲和风车草两种植物叶绿素的合成,而高浓度PFOS抑制叶绿素合成。为了全面探究不同浓度PFOS的生态毒性,本研究设置了高浓度暴露组(5、10 mg·L和20 mg·L)和低浓度暴露组(0.1 mg·L和1 mg·L)研究PFOS对拟南芥的代谢损伤机制。
本实验共设置5个添加不同浓度PFOS的染毒组和一个添加甲醇溶液的对照组(PFOS的溶剂),每组8个重复。在制备培养基前需要先分别配制100.0、1 000.0、5 000.0、10 000.0、20 000.0 mg·L的PFOS储备液用于拟南芥染毒实验。
称取31.56 g培养基粉末,加入800 mL超纯水和0.8 mL不同浓度PFOS溶液(对照组用甲醇溶液代替),拟南芥培养杯中PFOS浓度分别达到0.1、1.0、5.0、10.0 mg·L和20.0 mg·L。将添加PFOS后的混合溶液放入微波炉中加热至培养基粉末溶解,溶液透明呈淡黄色,调节pH至5.7±0.1,使用量筒均匀分装8杯,并用植物封口膜密封。放入高压蒸汽灭菌锅116℃灭菌30 min。
拟南芥种子用50%的乙醇溶液消毒3 min,同时加入0.5%Triton剂进行活化,无菌水冲洗3次。将灭菌后的拟南芥种子倒在无菌滤纸上,用无菌金属接种棒转移到1/2 MS培养基上,每个培养杯接种15粒,用无菌植物封口膜密封植物培养杯。将培养杯转移到植物培养箱中,培养条件为白天25℃,夜晚22℃,光照周期为16∶8(光暗比),湿度为50%。
1.3 代谢组学前处理方法
采集培养30 d后的拟南芥叶片,将其先置于液氮中15 s,再放入超低温冰箱-70℃过夜。冷冻后的拟南芥叶片转移至IKA破碎机中磨成粉末,最后放入冷冻干燥机中进行冷冻干燥。
称取20 mg冻干的拟南芥叶片粉末放入1.5 mL EP管中,依次添加200 µL甲醇、540 µL甲基叔丁基醚和360 µL超纯水并涡旋30 s,然后放入多管涡旋振荡器振荡20 min,并在室温下静置10 min,用来固液分离。得到的下层淡黄色液体转移至新的EP管中,氮吹30 min,加入100µL复溶剂复溶(甲醇/水=1∶4,/)。再将复溶后的溶液放入高速台式冷冻离心机,4℃15 000 r·min离心20 min,将上层溶液转移到样品瓶中进行代谢组学分析。
1.4 代谢组学仪器分析方法
色谱条件:色谱柱为美国Waters ACQUITY UPLCHSS T3色谱柱(2.1 mm×100 mm,1.8µm),柱温50℃。正离子模式下流动相A为添加0.1%甲酸和5 mmol·L甲酸铵的超纯水,流动相B为添加0.1%甲酸的乙腈;
负离子模式下流动相A为添加5 mmol·L甲酸铵的超纯水(氨水调节pH为7.5),流动相B为乙腈。线性洗脱以0.30 mL·min流速按照以下程序进行洗脱(时间,B%):(0 min,3%),(1.5 min,3%),(11.0 min,80%),(14.0 min,97%),(18.0 min,97%),(18.1 min,3%)并保持3.9 min。进样器温度为4℃,进样量为2µL。
质谱条件:以ESI和ESI两种模式进行扫描。电喷雾电离(ESI)参数:雾化气(GS1),50 psi(1 psi=6 895 Pa);
辅助气(GS2),50 psi;
气帘气(CUR),35 psi;
离子源(IS),5 500V/-4 500 V;
TIS探针温度,500℃;
去簇电压(DP),80 V/-80 V;
质谱扫描范围为70~1 200 amu;
MS分析的碰撞能为15、30 V和45 V。
1.5 数据处理与分析
使用SCIEX自带的分析软件进行分析。将HPLC-QTOF的原始数据和原始质谱信息使用SCIEX OS软件处理峰,提取峰面积并鉴定。根据前期构建的代谢组学数据库中的二级离子碎片与拟南芥内源代谢物信息进行定性分析。对于代谢组学数据库没有MS的代谢物,通过与网站数据库(METLIN、Mass Bank和HMBD)匹配,将匹配分数>80%认定为拟南芥内源代谢物。将识别出的代谢物峰面积导入SIMCA-P软件(Umetrics,瑞典)和MetaboAnalyst 5.0(http://www.metaboanalyst.ca)进行检验、主成分分析(PCA)、偏最小二乘回归分析(PLS-DA)和正交偏最小二乘判别分析(OPLS-DA)。结合变量投影重要性()和值筛选差异代谢物,值>1.0且<0.05时认为具有统计学显著差异(值使用FDR校正),是影响拟南芥代谢的差异代谢物。差异代谢物通过KEGG数据库(www.genome.jp/KEGG/ligand.html)和MetaboAnalyst 5.0(拟南芥途径)进行代谢路径分析,将<0.05的代谢路径列为差异代谢路径。
2.1 拟南芥叶片代谢物图谱分析
通过HPLC-QTOF检测和本地内源代谢物数据库的定性分析,共鉴定出220个内源代谢物。通过对全部代谢物的峰面积进行PCA分析,获得了对照组和染毒组之间的总体可视化差异。由图1可知,PC1和PC2分别解释了代谢物总体变化的45.7%和12.3%。通过PCA分析发现,高浓度暴露组和低浓度暴露组组间呈现出显著的分离趋势,可见PFOS高、低暴露条件对拟南芥代谢产生的影响具有明显差异。高低浓度暴露组均呈现出随着PFOS浓度的升高,对拟南芥代谢的影响增大的趋势,表明高、低暴露组内均具有明显的正向剂量效应关系。LI等研究发现,在PCA得分图中,低浓度PFOS暴露不能与对照组分开。而本研究中所有暴露组只有最低暴露组(0.1 mg·L)没有与对照组呈现明显的分离趋势。二者相同的PCA分析结果表明,低浓度PFOS暴露组对拟南芥代谢的影响不显著。
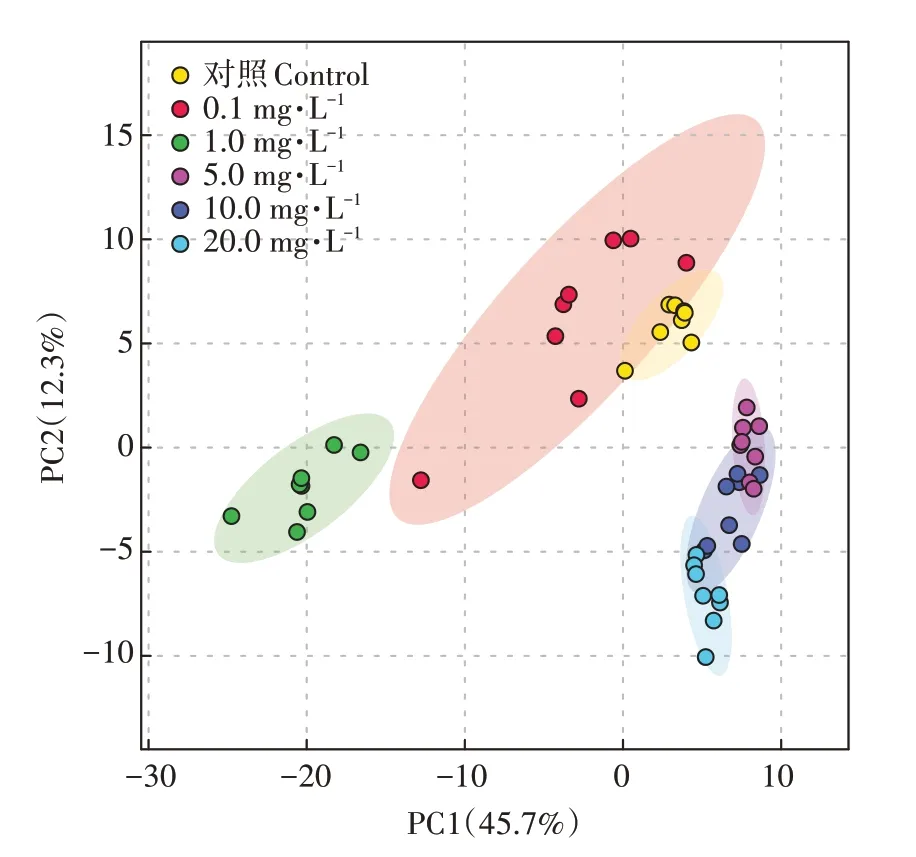
图1 拟南芥叶片对照组与PFOS暴露组PCA得分图Figure 1 PCA score plot according to the metabolic characteristics of Arabidopsis thaliana leaves exposed to PFOS at different concentrations
2.2 差异代谢物分析
为了更好地筛选出PFOS影响拟南芥的差异代谢物,将各染毒组与对照组进行比较,采用代谢组学中常用的方法,值>1.0且<0.05被认为具有统计学显著差异。由表1可以看出,差异代谢物与对照组相比,在PFOS暴露浓度为0.1 mg·L的拟南芥叶片中筛选出11种差异代谢物;
PFOS暴露浓度为1.0 mg·L的拟南芥叶片中筛选出24种差异代谢物;
PFOS暴露浓度为5.0 mg·L的拟南芥叶片中筛选出23种差异代谢物;
PFOS暴露浓度为10.0 mg·L的拟南芥叶片中筛选出26种差异代谢物;
PFOS暴露浓度为20.0 mg·L的拟南芥叶片中筛选出29种差异代谢物。从差异代谢物的数量来看,低浓度暴露组和高浓度暴露组均呈现出正向剂量效应关系。

表1 不同PFOS暴露浓度组在拟南芥叶片中的差异代谢物Table 1 Biomarkers in Arabidopsis thaliana leaves of experimental groups with different PFOS exposure concentrations
2.3 代谢通路分析
通过对拟南芥代谢通路的分析可知(图2),低浓度水平(0.1 mg·L和1.0 mg·L)主要参与的是氧化应激反应中的苯丙烷代谢和能量代谢中的糖类代谢,其原因可能是拟南芥为降解PFOS而提高了自身的氧化应激能力,同时消耗大量能量进一步增强其降解PFOS的能力。而当PFOS浓度达到5.0 mg·L水平时,拟南芥的氨基酸代谢受到损伤,浓度达到10.0 mg·L水平时,除了氨基酸代谢受到损伤外,还增加了8种受损伤的代谢通路,包括不饱和脂肪酸的生物合成、氨酰tRNA生物合成、苯丙烷生物合成、角质、木栓碱和蜡质的生物合成、脂肪酸生物合成、芥子油甘生物合成和α-亚麻酸代谢。当PFOS浓度达到20 mg·L水平时,硫代谢通路也受到PFOS损伤。由此可以看出,低浓度水平时为抗胁迫防御阶段,拟南芥为提高自身防御能力启动了能量代谢中糖代谢和氧化应激反应中苯丙烷代谢,从而降低PFOS的毒性。高浓度水平时为自身防御与代谢损伤阶段,拟南芥无法降解PFOS,拟南芥在自身防御的同时,PFOS对拟南芥多种代谢通路也造成了损伤,且随其浓度的升高代谢通路损伤的数量和程度也在增加。由此可以解释PCA图中低浓度和高浓度水平的暴露组产生显著分离的现象。
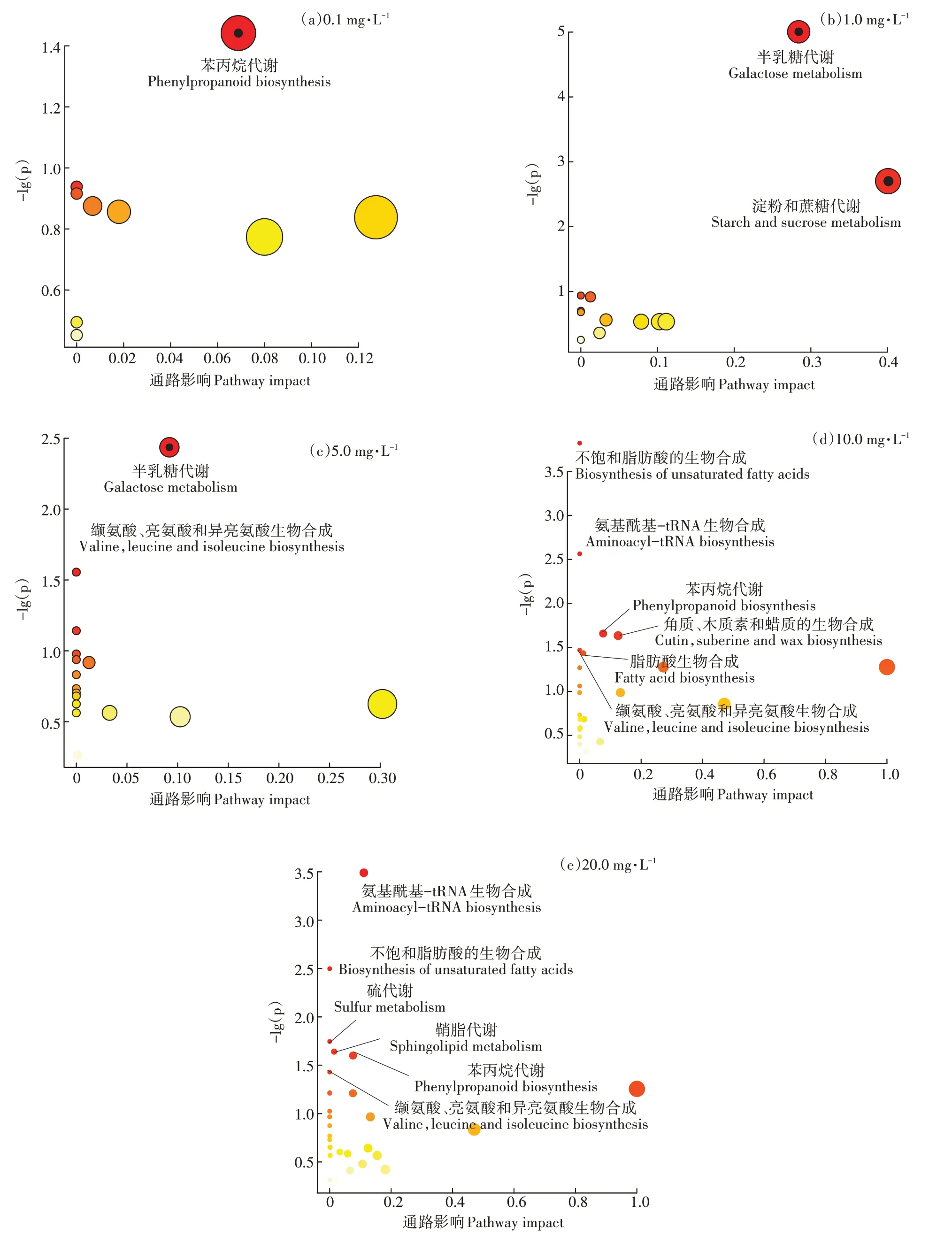
图2 不同浓度PFOS暴露对拟南芥叶片代谢通路的影响Figure 2 Effects of different concentrations PFOS exposure on metabolic pathway in Arabidopsis thaliana leaves
2.4 初级代谢分析
氨基酸作为植物中的重要物质,参与了许多细胞反应并影响着植物的生理过程,如植物生长发育、能量代谢、氧化还原能力的产生以及抵抗逆境胁迫。研究表明,在毒死蜱对水稻的暴露实验中,随着毒死蜱暴露水平的升高,水稻中游离氨基酸水平增加(29.02%),与氨基酸有关的酶的基因表达上调。在PFOS暴露实验中,当PFOS暴露浓度超过5.0 mg·L时,氨基酸代谢开始被干扰,缬氨酸、亮氨酸和异亮氨酸的生物合成被显著影响,其中亮氨酸和异亮氨酸的上调程度刚超过1倍,而缬氨酸尚未受到影响。有研究发现拟南芥中异亮氨酸会因甘露醇、聚乙二醇和除草剂的处理而增加。此外,也有研究发现暴露于PFOS和PFOA的秀丽线虫中的缬氨酸、亮氨酸和异亮氨酸生物合成也受到了显著影响。PFOS暴露浓度为10、20 mg·L时,亮氨酸和异亮氨酸上调倍数上升至1.6倍,拟南芥叶片中脯氨酸也受到了影响。当植物遭受胁迫时,脯氨酸通常会大量积累,这可能是因为脯氨酸有助于稳定植物的亚细胞结构、清除自由基、调节植物细胞功能,从而触发基因表达。此外,脯氨酸代谢也与戊糖磷酸、三羧酸循环和嘌呤合成等植物代谢途径密切相关。由此可见,随着PFOS暴露浓度的升高,拟南芥叶片中被影响的氨基酸种类和程度均在增加。

续表1不同PFOS暴露浓度实验组在拟南芥叶片中的差异代谢物Continued table 1 Biomarkers in Arabidopsis thaliana leaves of experimental groups with different PFOS exposure concentrations

续表1不同PFOS暴露浓度实验组在拟南芥叶片中的差异代谢物Continued table 1 Biomarkers in Arabidopsis thaliana leaves of experimental groups with different PFOS exposure concentrations
植物通过调节糖的代谢和运输来改善由非生物胁迫带来 的 负面影响。LI等发现在PFOA和PFOS的混合污染下,生菜中多种碳水化合物水平发生变化,这可能是生菜维持体内细胞正常活动并增加耐受性的表现。本实验在PFOS的暴露下,半乳糖代谢及淀粉和蔗糖代谢是主要被影响的糖代谢。非生物胁迫下,半乳糖代谢极易受到影响,这可能与半乳糖代谢可以促进植物中某些强抗氧化剂的产生,提高植物非生物胁迫耐受性有关。同样地,淀粉和蔗糖代谢通过生成一系列重要的糖,也在植物的胁迫反应中起着关键作用。高水平的蔗糖积累可以帮助植物
维持渗透平衡、稳定膜系统。蔗糖代谢过程中产生的糖,在非生物胁迫中充当着信号分子的作用,调节植物的基因表达,用于与植物激素、氧化和防御信号的协同。PFOS暴露浓度为1 mg·L时影响糖类的数量最多,对拟南芥叶片的糖代谢影响最大。随着PFOS暴露浓度的增加,对糖类的影响降低,这可能是由于低浓度时抵抗PFOS胁迫过程向高浓度PFOS对拟南芥产生代谢损伤转移导致的,同时代谢损伤破坏了糖代谢激发氧化应激反应的能力。
B族维生素对植物生长发育至关重要,因为它们是许多基础代谢辅助因子的前体,但其在非生物胁迫下容易被破坏。PFOS浓度为0.1 mg·L时,泛酸(维生素B5)的含量增加了20%。泛酸最重要的代谢功能是合成辅酶A,而辅酶A是包括脂质代谢、类固醇合成、三羧酸循环和氨基酸代谢在内的100多个合成和降解反应中必不可少的辅助因子。一些将泛酸转化为辅酶A的基因已被证明能够提高植物在非生物胁迫下的抗逆性。较低浓度的PFOS可能促进了泛酸的增加与转化,从而帮助拟南芥抵抗胁迫。此外,高浓度PFOS暴露使得烟酸(维生素B3)含量大幅增加。烟酸可增加植物对重金属的耐受性,可能是因为非生物胁迫下烟酸可帮助植物储存某些酶。
当PFOS暴露浓度超过10 mg·L时,被影响的脂质明显变多,主要为脂肪酸、鞘脂和脂肪酰。大量的动物学实验证明PFOS可以干扰动物的脂质代谢,使棕榈酸(16∶0)、棕榈油酸(16∶1)、油酸(18∶1)、亚油酸(18∶2)、ɑ-亚麻酸(18∶3)等拟南芥叶片中的主要脂肪酸含量发生显著升高。油酸(18∶1)水平对拟南芥的防御反应至关重要,它可以与茉莉酸协同反应,提高植物的耐受性。亚油酸(18∶2)和ɑ-亚麻酸(18∶3)是植物膜脂中的主要多不饱和脂肪酸,在重金属毒化的植物中,由于活性氧(ROS)的积累和酶活性的改变,亚油酸(18∶2)和ɑ-亚麻酸(18∶3)发生氧化作用,从而破坏了膜的完整性。但是亚油酸(18∶2)和ɑ-亚麻酸(18∶3)水平的增加,可以减缓细胞膜的破坏作用。随着PFOS暴露浓度的升高,脂质受影响的种类和程度显著升高,这可能与保护拟南芥的细胞膜可增加植物耐受性有关。
PFOS暴露的拟南芥中核苷酸有关物质明显受到影响,分别为腺苷和腺苷酸基琥珀酸。据报道,PFOS可干扰DNA代谢的内环境稳定并造成DNA损伤。腺苷和腺苷酸基琥珀酸均参与了嘌呤代谢。脲类化合物是嘌呤分解代谢产生的含氮化合物,有助于植物的氮循环并调节非生物胁迫反应,某些高浓度的脲类化合物可通过减少氧化损伤提高非生物胁迫耐受性。
2.5 次级代谢分析
植物激素可以引起信号分子间的协同和拮抗作用,触发对非生物胁迫的有效防御反应。被PFOS暴露影响的植物激素均为与细胞分裂素有关的代谢物。细胞分裂素在植物抗逆中的作用机制,除了调控对胁迫有关基因的转录,还可能是其与胁迫信号之间发生了复杂的相互作用。ZWACK等发现随着胁迫反应的增强,细胞分裂素水平呈现先升高再降低的趋势。本实验中PFOS对细胞分裂素有关代谢物的影响,也呈现同样的变化趋势。
苯丙素类代谢物是植物抗氧化反应中常见的多酚类物质,杀菌剂戊唑醇的暴露使生菜中苯丙素类代谢物发生显著变化。随着PFOS暴露浓度的升高,拟南芥叶片中苯丙素类代谢物水平上调。在非生物胁迫的条件下,苯丙烷代谢被激活,积累大量的酚类化合物清除有害的ROS。拟南芥中被PFOS暴露影响的苯丙素类代谢物主要为木质素前体(Monolignols)。非生物胁迫产生的ROS,可能与木质素反应生成信号分子,引发植物防御反应。此外,木质素还可以作为抗氧化剂清除ROS,并限制ROS的产生。木质化程度的增加有助于改善植物的机械支撑以及水分运输,加强细胞壁适应植物防御机制。随着PFOS暴露浓度的增加,拟南芥中木质素前体代谢物水平上升,这与CABANÉ等提出的响应非生物胁迫的木质素前体物增加理论一致。
拟南芥中山奈酚和槲皮素及其衍生物是主要受到PFOS影响的黄酮类代谢物。0.1 mg·L的低浓度水平时,黄酮类代谢物并未受到PFOS的干扰,而当PFOS暴露浓度高于1 mg·L时黄酮类化合物呈现明显的下调趋势,可能是由于ROS清除过程消耗了大量的黄酮类化合物,而当PFOS浓度达到最高浓度20 mg·L时,黄酮类化合物却呈现明显的上调现象,可能是由于高浓度PFOS对拟南芥造成损伤导致ROS产生过少或者不产生,引起黄酮类化合物消耗量小于产生量。类黄酮的抗氧化特性源自结构中含有OH基团,这使得类黄酮成为有效的ROS清除剂,抑制胁迫反应产生的ROS聚集。此外,在重金属毒化的拟南芥中,槲皮素可以改善植物胁迫反应,增加拟南芥对重金属的耐受性。
在非生物胁迫下,植物中吲哚类代谢物合成途径受到影响。PFOS暴露浓度大于5 mg·L时,拟南芥中吲哚类代谢物水平降低。拟南芥中富含吲哚和吲哚衍生物,部分为色氨酸衍生物,其存在于根和叶的可溶性部分或细胞壁结合部分或根分泌物中,在十字花科植物的防御体系中起着重要作用。此外,作为拟南芥特有的吲哚硫化合物,camalexin在PFOS暴露下也呈现相同趋势。可见PFOS的暴露对吲哚类代谢造成了明显的损伤效应。
芥子油苷被认为是拟南芥最具特征的次生代谢产物。PFOS暴露浓度为1 mg·L时,拟南芥中被影响的芥子油苷最多,并且呈现显著的上调趋势。而当浓度高于1 mg·L时,芥子油苷并未呈现明显的被干扰现象。芥子油苷的信号机制可以作为信号分子,与植物胁迫反应相互协同。当PFOS暴露浓度大于10 mg·L时,具有信号分子功能的糖脂修饰复合物(Arabidopsides A、B和C)水平发生了明显改变。可见PFOS暴露条件下信号分子的代谢行为非常复杂,需要进一步探究其机制。
(1)低浓度PFOS暴露时,拟南芥为提高自身防御能力启动了能量代谢中糖代谢和氧化应激反应中苯丙烷代谢来降低其毒性。高浓度暴露时,拟南芥启动了更多自身防御代谢通路,同时对氨基酸、糖类、植物激素、维生素和核酸等初级代谢和植物激素、苯丙素、类黄酮、吲哚类和芥子油苷等次级代谢造成一定程度的损伤效应。
(2)PFOS高浓度暴露与低浓度暴露对拟南芥的代谢效应存在较大差异,为后期全氟化合物的毒性效应研究提供了理论依据,同时发现信号分子的传导和干扰可以作为后期研究的重点内容。
猜你喜欢 低浓度代谢物拟南芥 低浓度二氧化碳快速集获器面世科学导报(2022年32期)2022-06-09揭示昼夜节律对玉米蛋白质与代谢组学的调控对杂种优势的贡献(2020.10.3 eplants)三农资讯半月报(2020年19期)2020-10-27低浓度粉尘测量仪检定装置的应用及测量结果的不确定度评定中国科技纵横(2017年7期)2017-05-16不同生物膜滴滤池处理低浓度污水的效果江苏农业科学(2017年1期)2017-02-27拟南芥飞碟探索(2015年9期)2015-11-05口水暴露了身份红领巾·探索(2015年9期)2015-09-10酸碱条件对枯草芽胞杆菌FJAT—14254代谢物产生的影响①热带农业科学(2015年4期)2015-06-18肠道差自闭症风险高分忧(2015年3期)2015-06-08我们的呼吸“指纹”大科技·百科新说(2014年5期)2014-06-10城市低浓度污水处理工艺研究中国高新技术企业(2014年7期)2014-06-06下一篇:蔬菜废弃物好氧堆肥处理研究进展
